ФОТОХИМИЯ
раздел
химии, в к-ром изучаются реакции химические, происходящие под действием
света. Ф. тесно связана с оптикой и оптическими излучениями.
Первые фотохимич. закономерности были установлены в 19 в. (см. Гротгуса
закон, Бунзена - Роско закон). Как самостоятельная область науки Ф.
оформилась в 1-й трети 20 в., после открытия Эйнштейна закона, ставшего
основным в Ф. Молекула вещества при поглощении кванта света переходит из
основного в возбуждённое состояние, в к-ром она и вступает в химич. реакцию.
Продукты этой первичной реакции (собственно фотохимич.) часто участвуют
в различных вторичных реакциях (т. н. темневые реакции), приводящих к образованию
конечных продуктов. С этой точки зрения Ф. можно определить как химию возбуждённых
молекул, образовавшихся при поглощении квантов света. Часто более или менее
значит. часть возбуждённых молекул не вступает в фотохимич. реакцию, а
возвращается в основное состояние в результате различного рода фотофизич.
процессов дезактивации. В ряде случаев эти процессы могут сопровождаться
испусканием кванта света (флуоресценция или фосфоресценция). Отношение
числа молекул, вступивших в фотохимич. реакцию, к числу поглощённых квантов
света наз. квантовым выходом фотохимич. реакции. Квантовый выход первичной
реакции не может быть больше единицы; обычно эта величина значительно меньше
единицы из-за эффективной дезактивации. Вследствие же темновых реакций
общий квантовый выход может быть значительно больше единицы.
Наиболее типичная фотохимич.
Эти атомы вступают во вторичную
Такие процессы происходят,
При освещении смеси хлора
C1 + RH->HC1 + R R + Cl Общий квантовый выход этой
При освещении ртутной лампой
Hg* + H Это пример сенсибилизированной
Простейший фотохимич. процесс
(Fe2+)* + H Вторичные реакции приводят
В жидкой фазе молекулы органич.
Задача изучения механизма
Один из наиболее эффективных
Область практич. приложения
Лит.: Турро Н. Д.,
А. Н., Фотоника молекул красителей
X. С., Двухквантовая фотохимия,
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
реакция в газовой фазе - диссоциация молекул с образованием атомов и радикалов.
Так, при действии коротковолнового ультрафиолетового (УФ) излучения, к-рому
подвергается, напр., кислород, образующиеся возбуждённые молекулы О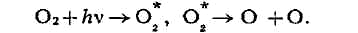
реакцию с О
напр., в верхних слоях атмосферы под действием излучения Солнца (см. Озон
в атмосфере).
с насыщенными углеводородами (RH, где R - алкил) происходит хлорирование
последних. Первичная реакция - диссоциация молекулы хлора на атомы, за
ней следует цепная реакция образования хлоруглеводородов:
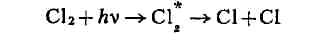
цепной реакции значительно больше единицы.
смеси паров ртути с водородом свет поглощается только атомами ртути. Последние,
переходя в возбуждённое состояние, вызывают диссоциацию молекул водорода:
H + H.
фотохимич. реакции. Под действием кванта света, обладающего достаточно
высокой энергией, молекулы превращаются в ионы. Этот процесс, наз. фотоионизацией,
удобно наблюдать с помощью масс-спектрометра.
в жидкой фазе - перенос электрона, т. е. вызванная светом окислительно-восстановительная
реакция. Напр., при действии УФ света на водный раствор, содержащий ионы
Fe2+, Сr2+, V2+ и др., электрон переходит
от возбуждённого иона к молекуле воды, напр.:
+ ОН- + Н+.
к образованию молекулы водорода. Перенос электрона, к-рый может происходить
при поглощении видимого света, характерен для мн. красителей. Фотоперенос
электрона с участием молекулы хлорофилла представляет собой первичный акт
фотосинтеза - сложного фотобиологич. процесса, происходящего в зелёном
листе под действием солнечного света.
соединений с кратными связями и ароматич. кольцами могут участвовать в
разнообразных темновых реакциях. Кроме разрыва связей, приводящего к образованию
радикалов и бирадикалов (напр., карбе-нов), а также гетеролитич.
реакций замещения, известны многочисл. фотохимич. процессы изомеризации,
перегруппировок, образования циклов и др. Существуют органич. соединения,
к-рые под действием УФ света изомеризуются и приобретают окраску, а при
освещении видимым светом снова превращаются в исходные бесцветные соединения.
Это явление, получившее название фотохромии,- частный случай обратимых
фотохимич. превращений.
фотохимич. реакций весьма сложна. Поглощение кванта света и образование
возбуждённой молекулы происходят за время порядка 10-15 сек.
Для органич. молекул с кратными связями и ароматич. кольцами, представляющих
для Ф. наибольший интерес, существуют два типа возбуждённых состояний,
к-рые различаются величиной суммарного спина молекулы. Последний может
быть равен нулю (в основном состоянии) или единице. Эти состояния наз.
соответственно синглетными и триплетными. В синглетное возбуждённое состояние
молекула переходит непосредственно при поглощении кванта света. Переход
из синглетного в триплетное состояние происходит в результате фотофизич.
процесса. Время жизни молекулы в возбуждённом синглет-ном состоянии составляет
10-8 сек; в триплетном состоянии - от 10-5
- 10-4 сек (жидкие среды) до 20 сек (жёсткие среды,
напр. твёрдые полимеры). Поэтому мн. органич. молекулы вступают в химич.
реакции именно в триплетном состоянии. По этой же причине концентрация
молекул в этом состоянии может стать столь значительной, что молекулы начинают
поглощать свет, переходя в высоковозбуждённое состояние, в к-ром они вступают
в т. н. двухквантовые реакции. Возбуждённая молекула А* часто образует
комплекс с невозбуждённой молекулой А или с молекулой В. Такие комплексы,
существующие только в возбуждённом состоянии, наз. соответственно эксимерами
(АА)* или эксиплексами (АВ)*. Эксиплексы часто являются предшественниками
первичной химич. реакции. Первичные продукты фотохимич. реакции - радикалы,
ионы, ион-радикалы и электроны - быстро вступают в дальнейшие темновые
реакции за время, не превышающее обычно 10-3 сек.
методов исследования механизма фотохимич. реакций - импульсный фотолиз,
сущность к-рого заключается в создании высокой концентрации возбуждённых
молекул путём освещения реакционной смеси кратковременной, но мощной вспышкой
света. Возникающие при этом короткоживущие частицы (точнее - возбуждённые
состояния и названные выше первичные продукты фотохимич. реакции) обнаруживаются
по поглощению ими "зондирующего" луча. Это поглощение и его изменение во
времени регистрируется при помощи фотоумножителя и осциллографа. Таким
методом можно определить как спектр поглощения промежуточной частицы (и
тем самым идентифицировать эту частицу), так и кинетику её образования
и исчезновения. При этом применяются лазерные импульсы продолжительностью
10-8 сек и даже 10-11- 10-12 сек,
что позволяет исследовать самые ранние стадии фотохимич. процесса.
Ф. обширна. Разрабатываются способы химич. синтеза на основе фотохимич.
реакций (см. Фотохимический реактор, Солнечная фотосинтетическая установка).
Нашли применение, в частности для записи информации, фотохромные соединения.
С применением фотохимич. процессов получают рельефные изображения для микроэлектроники,
печатные формы для полиграфии (см. также Фотолитография). Практич.
значение имеет фотохимич. хлорирование (гл. обр. насыщенных углеводородов).
Важнейшая область практич. применения Ф. - фотография. Помимо фотографич.
процесса, осн. на фотохимич. разложении галоге-нидов серебра (гл. обр.
AgBr), всё большее значение приобретают различные методы несеребряной фотографии;
напр., фотохимич. разложение диазосоединений лежит в основе диазотипии.
Молекулярная фотохимия, пер. с англ., М., 1967; Теренин
и родственных органических соединений, Л., 1967; Калверт Д. Д., Питтс Д.
Н., Фотохимия, пер. с англ., М., 1968; Багдасарьян
М., 1976. X. С. Багдасарьян.