ГЕОХИМИЯ
(от гео...
и химия), наука о хим. составе Земли, законах распространённости и распределения
в ней хим. элементов, способах сочетания и миграции атомов в ходе природных
процессов. Г.-часть космохимии. Единицами сравнения в Г. являются атомы
и ионы.
Одна из важнейших задач Г.-
изучение на основе распространённости хим. элементов хим. эволюции Земли,
стремление объяснить на хим. основе происхождение и историю Земли, дифференциацию
её на оболочки (геосферы). Наибольшее внимание в Г. уделяется проблемам
распространённости и распределения хим. элементов.
Распространённость химических
элементов. Распространённость различных хим. элементов определяется синтезом
их ядер, происходящим по разным термоядерным реакциям в недрах звёзд. Стадия
эволюции звезды (её темп-ра) определяет характер этого синтеза.
Согласно наиболее распространённым
Непосредственное определение
и многие др. Элементы с четно-нечётным
напр. Из данных о хим. составе
К. Г. Превитту, ионные (в
Отношение силикатной и металлич.
Распределение химических
равновесие смещается вправо,
начинающейся при темп-ре
равновесие сдвигается вправо.
Рис. 1. Распространённость
Условия равновесия подчиняются
Закономерности распределения
В природных процессах разделения
редкоземельные элементы С открытием изотопов стала
Геохим. процессы разделения
космогонич. гипотезам (см. Космогония), при образовании Солнца из сжимающейся
и вращающейся туманности на заключит. стадии сжатия от центр, сгущения
отделилась значит, масса горячей плазмы которая
образовала вокруг него про-топланетное облако в виде диска. Облако быстро
охлаждалось, и в нём возникла спонтанная конденсация вещества. В результате
многостадийных реакций (конденсационный рост ядер, их коагуляция, процессы
аккреции и агломерации) газовое облако превратилось в газопылевое. Одновременно
происходила потеря облаком газов в космическое пространство. Холодное газопылевое
облако в силу ротационной неустойчивости разбилось на ряд сгущений - протопланет,
к-рые адиабатически сжимались. Благодаря этому процессу из холодного вещества
протопланетного облака образовались планеты земного типа и астероидный
пояс с астероидами и метеоритами. Наконец, на периферии протопланетного
облака происходила при очень низких абс. темп-pax конденсация отлетевших
газов (Н, Не, NHs, CH
общего состава планеты невозможно. Однако астрономические (спектральные)
данные о составе Солнца и данные о хим. составе кам. метеоритов (наиболее
распространённых-хондритов) позволяют судить о распространённости хим.
элементов на Земле и на др. планетах. Из табл. 1 видно, что распространённость
элементов на Солнце и в метеоритах совпадают. Наиболее распространённые
элементы (изотопы) имеют чётные по протонам и чётные по нейтронам ядра: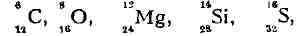
числом протонов или нейтронов занимают среднее место. Элементы с нечётным
числом протонов и нейтронов имеют очень малую распространённость,
Распространённость элементов с чётным порядковым номером больше соседних
с нечётными номерами (рис. 1). Лёгкие элементы Li, Be, В находятся в дефиците,
т. к. "сгорают" в реакциях с протонами. Ядра элементов конца Менделеевской
системы имеют огромный избыток нейтронов и потому неустойчивы. Эти элементы
претерпевают радиоактивный распад (U, Th, Ra и др.) и спонтанное деление
(U, Th, нек-рые актиниды).
оболочек Земли следует, что Земля имеет метеоритный состав. Метеориты разделяются
на каменные (хондриты и более редкие ахондриты), железные (из Fe-Ni сплава)
и смешанные. Хондриты потеряли все летучие вещества, кроме тех, к-рые прочно
вошли в соединение с твёрдым веществом метеоритов - H
(по числу атомов Si/Mg = l), затем S, A1, Са и др. Силикатная фаза хондритов
состоит преим. из мета- и ортосиликатов (см. Силикаты)- пироксенов (MgSiO
сульфидную, хромитную, карбидную, фосфидную фазы.
1.- Распространённость химических элементов на Солнце и в каменных метеоритаж
(хондритах) ( - число атомов данного элемента на
на
106 атомов магния)
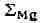
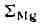
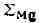
Н
Li
Be
В
С
N
О
F
На
Mg
,00.104
А1
Si
104
Р
S
Сl
К
Са
Sc
Ti
,9.103
V
Cr
Mn
103
Fe
Co
92.103
Ni
Cu
Zn
,4.102
Ga
,36
,06
Ge
,35
As
Sc
Br
Rb
,3.101
Sr
,66
,85.101
Y
,84
Zr
Nb
Mo
Ru
,60
Rh
Pd
Ая
Cd
In
,2
.10-3
Sn
Sb
0,88
Те
,90
I
,71
Cs
,22.10-1
Ba
La
Ce
Pr
,15.10-1
Nd
Sm
,8
Eu
Gd
Tb
Dy
Ho
Er
,94.10-1
Tm
Yb
Lu
Hf
10-1
Та
W
Re
Os
Ir
Pt
Au
HS
Tl
Pb
Bi
,63
Th
U
,02.10-2
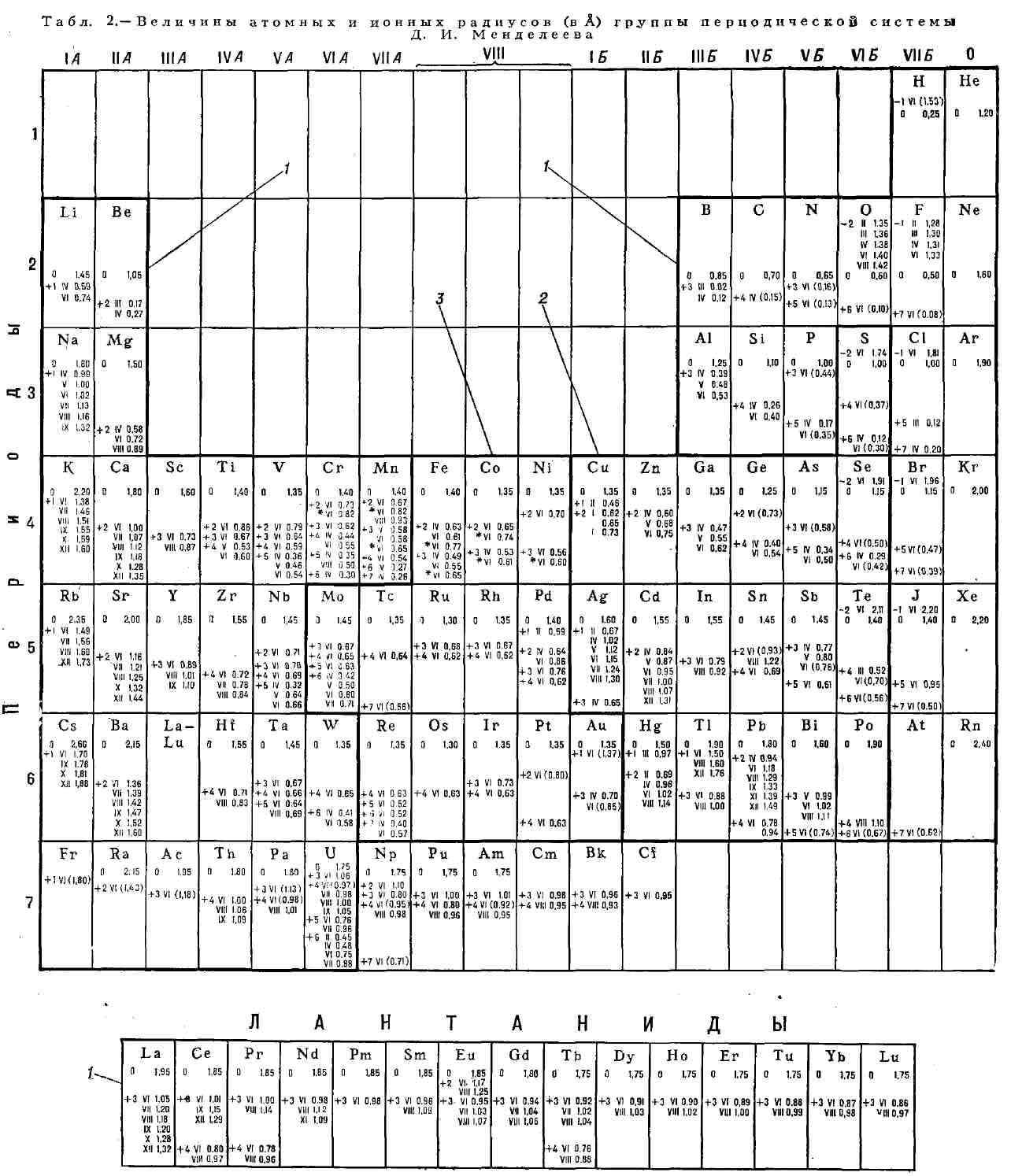
Цифры со стрелками
обозначают поля элементов (оконтурены жирной линией): <2 - халькофильных; <3 - сидеро-фильных. Для каждого элемента
приведены значения атомного радиуса (0) <и ионных радиусов при различных
валентностях и координационных числах (обозначены римскими цифрами). Звёздочка
обозначает пара- или ферромагнитное состояние переходных элементов; отсутствие
звездочки - диамагнитное состояние. Атомные радиусы даны по Дж. Слейтеру,
ионные - по Р. Д. Шеннону и
скобках) - по Л. Аренсу.
фаз в разных метеоритах варьирует. Мн. учёные, исходя из аналогии с метеоритами,
считают, что планеты земного типа имеют также силикатную фазу и металлич.
ядро, причём отношения между этими фазами у разных планет различны. По
этой гипотезе, Земля имеет ок. 31% металлич. фазы, или ок. 40% Fe (включая
окисленное).
элементов. Земля, как и др. планеты земного типа и Луна, имеет оболочечное
строение; она состоит из ряда геосфер: ядра, мантии, земной коры, гидросферы
и атмосферы (см. Земля). Твёрдые оболочки Земли, слагающие их горные породы,
парагенетич. ассоциации минералов и т. п., как правило,- сложные многокомпонентные
силикатные системы. Процессы, при к-рых они образуются, идут с конечными
скоростями и являются необратимыми. В Г. мы встречаемся с неравновесными
системами, к-рые характеризуются массой, объёмом, энтропией, давлением,
темп-рой, хим. потенциалами. Для применения термодинамики в Г. необходимо
знать поведение конкретных фаз, компонентов и систем в условиях геол. обстановки,
в частности в большом диапазоне давлений и темп-р. Так, напр., общее представление
о направлении геохим. процесса даёт Ле Шателье - Брауна принцип, согласно
к-ро-му в любой системе, находящейся под действием внеш. сил, изменение
к.-л. внеш. фактора вызывает превращение, направленное на компенсацию действия
этого фактора. По действующих масс закону изменение активности одного из
компонентов системы смещает равновесие. Напр., в реакции
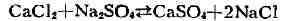
т. к. ангидрит выпадает из раствора. В реакции
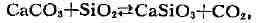
выше 350 0С, равновесие сдвигается вправо, т. к. одновременно
с отложением минерала вол-ластонита СаSiO
фазы равновесие смещается в сторону меньшего объёма газовых компонентов.
Напр., в реакции
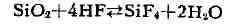
Высокое давление (газовое и литостатическое) изменяет направление и характер
кристаллизации магмы.
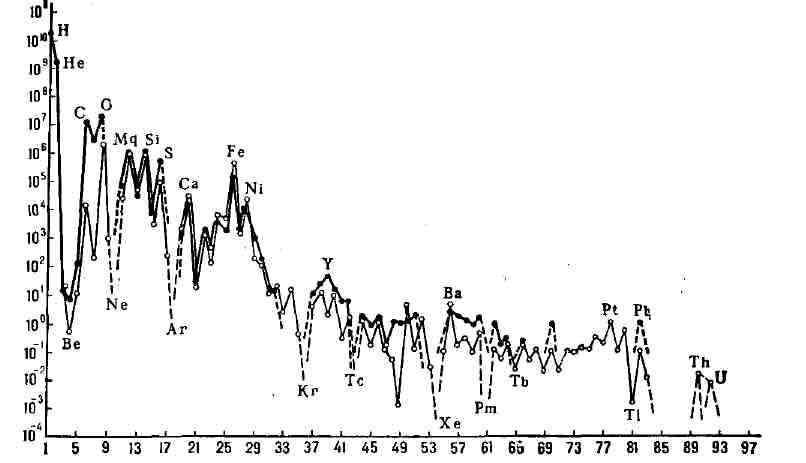
химических элементов на Солнце и в каменных метеоритах
и в каменных метеоритах
(хондритах) ; по оси абсцисс - порядковые номера
; по оси абсцисс - порядковые номера
элементов, по оси ординат- число атомов данного элемента на 10* атомов
Mg.
также правилу фаз Гиббса (см. фаз правило), согласно к-рому число термодинамических
степеней свободы системы f = k- -п + 2, где n- число фаз в системе, k -
число компонентов. Поскольку в закрытой системе число степеней свободы
f =< 2 (давление и темп-pa), то число фаз n>=k. Это минералогич. правило
фаз, впервые в Г. применённое В. М. Гольдшмид-том, оправдывается для разнообразных
горных пород.
отдельных элементов по многочисленным фазам - минералам зависят гл. обр.
от строения внешних электронных оболочек атомов. В Г. поэтому широко используются
закономерности, установленные кри-сталлохимией. Ионы и атомы в кристал-лич.
решётках имеют разные радиусы R
R
ионы и атомы сортируются по своим размерам. Кристаллич. решётки гл. породообразующих
минералов принимают одни ионы (или атомы) и не принимают другие, в зависимости
от их величины, заряда и др. свойств. Если ионы разновалентны, но имеют
близкий размер R
не больше чем на 15%, они часто изоморфно замещаются в кристаллич. решётках;
происходит замещение атома атомом, иона ионом или группы атомов группой
атомов, в зависимости от типа решётки, размеров R
элементов по различным минералам. Использование R, в Г. объяснило причину
ассоциации таких разнородных элементов, как U, Th и редкоземельных элементов
(в минералах то-рианит, иттриалит и др.), а также постоянную ассоциацию
редкоземельных элементов. При деформации одного иона другим в соединении,
имеющем катион малого радиуса и анион большого радиуса, возникает т. н.
поляризация, к-рая нарушает физ.-хим. свойства вещества - твёрдость, летучесть
и мн. др. Отношение R
т. е. координационное число. Оно в свою очередь указывает на характер и
строение кристаллич. решётки. Координац. число может изменяться в зависимости
от условий образования минерала. Кристаллич. решётки минералов имеют различную
структуру - от очень простых и симметричных построек из плотно упакованных
шаров до весьма сложных с низкой степенью симметрии. При кристаллизации
атомы и ионы стремятся расположиться в кристаллической решётке таким образом,
чтобы была минимальной энергия кристаллической решётки. На основе всех
этих данных была создана геохимическая классификация элементов, опирающаяся
на физико-химические свойства химических элементов (табл. 3).
3. - Геохимическая классификация химических элементов
(железо)
ькофил ь-ные (сульфиды)
(силикаты и др.)
Ni, Co, Ru, Rh, Pd, Os, Ir, Pt, (Mo), Au, Re, (P),(As), (C), (Ge), (Ga),(Sn),
(Sb), (Cu)
Те, Си, Zn, Cd, Pb, Sn.Mo, Ge, As, Ga, Sb, Bi, Ag, Ни, In, Tl, (Fe),(Ni),(Co)
О, N, Si, Ti, Zr, Hf, F, Cl, Br, I, B, Al. Sc, Y, Li, Na, K, Rb, Cs, Be,Mg,Ca,Sr,Ba,Ra,
V, Cr, Mn, W, Th, Nb, Та, U, Ac, Pa, (S),(P),(Sn),(C).(Ga), (Fe), (Ni),(Co),
развиваться Г. изотопов - изучение процессов разделения изотопов хим. элементов
в природных процессах, особенно лёгких атомов Н, С, О, N, S и др. Этим
методом часто удаётся установить способ и условия разделения хим. элементов
и образования конкретных минералов и рудных залежей.
элементов на Земле поддерживаются прежде всего теплом, генерируемым радиоактивными
элементами (радиогенное тепло), гравитационной энергией. На поверхности
Земли значит, роль играет энергия солнечных лучей, к-рая, в частности,
трансформируется живым веществом в хим. энергию нефтей и углей.
Геохимические процессы.
Первичное разделение холодного недифференцированного вещества Земли
на оболочки произошло под влиянием тепла адиабатич. сжатия планеты и радиогенного
тепла. В мантии Земли на различных глубинах, особенно в астеносфере, возникали
многочисл. расплавл. очаги. Разделение на оболочки шло путём зонного плавления,
к-рое не требует полного расплавления мантии. Силикатное вещество планеты
разделялось на тугоплавкую фазу - ультраосновные породы верхней мантии,
и легкоплавкую фазу - основные породы (базальты) земной коры. Легкоплавкое
вещество проплавляло кровлю магматич. камеры, а тугоплавкое кристаллизовалось
на дне камеры; т. о. легкоплавкое вещество перемещалось вверх к поверхности
Земли. При этом метасиликаты инконгруентно разлагались на ортосиликаты
и кремне-кислоту, обогащённую хим. элементами, понижающими темп-ру плавления:
щелочными элементами, Si, Ca, Al, U, Th, Sr и др. редкими литофильными
элементами. Вещества, повышающие темп-ру плавления (Mg, Fe, Ni, Co, Сr
и др.), сохранились по преимуществу в тугоплавкой фазе, т. е. остались
в мантии Земли. Вместе с зонным плавлением шёл процесс дегазации верх,
мантии.
4. - Химический состав горных пород Земли, Луны и метеоритов
и элементы
метеориты (хондриты)
породы Земли
базальты Земли (толеитовые)
(базаль-тич. кам. метеориты)
поверхности Луны
состав осадочных пород Земли
Земли
(базальт)
диспергированные (реголит)
Аполлон-12"
% по массе
+ 2,51 Fe
( + 2,88 Fe
(+3,3 Fе
( + 1,6 Fe
18
10
% п о массе