ЭНТРОПИЯ
(от греч. entropia
- поворот, превращение), понятие, впервые введённое в термодинамике
для
определения меры необратимого рассеяния энергии. Э. широко применяется
и в др. областях науки: в статистической физике как мера вероятности
осуществления к.-л. макроскопич. состояния; в теории информации как мера
неопределённости к.-л. опыта (испытания), к-рый может иметь разные исходы.
Эти трактовки Э. имеют глубокую внутр. связь. Напр., на основе представлений
об информационной Э. можно вывести все важнейшие положения статистич. физики.
В термодинамике понятие "Э." было введено
Р. Клиузиусо.ч (1865), к-рый показал, что процесс превращения теплоты
в работу следует общей фнз. закономерности - второму началу термодинамики.
Его
можно сформулировать строго математически, если ввести особую функцию состояния
- Э.
Так, для термодинамич. системы, совершающей
квазистатически (бесконечно медленно) циклич. процесс, в к-ром система
последовательно получает малые количества теплоты 5О при соответствующих
значениях абс. темп-ры Т, интеграл от "приведённого" количества
теплоты оО/Т по всему циклу равен нулю
![]()
т. н. равенство Клаузиуса).
Это равенство, эквивалентное второму
началу термодинамики для равновесных процессов, Клаузнус получил, рассматривая
произвольный циклич. процесс как сумму очень большого, в пределе бесконечного,
числа элементарных обратимых Карно циклов. Математически равенство
Клаузпуса необходимо и достаточно для того, чтобы выражение
dS = о0/Г (1)
представляло собой полный дифференциал
функции состояния S, назв. "Э." (дифференциальное определение Э.).
Разность Э. системы в двух произвольных состояниях А и В (заданных,
напр., значениями темп-р н объёмов) равна
![]()
(интегральное определение Э.). Интегрирование
Т. о., из второго начала термодинамики
Согласно первому началу термодинамики
откуда следует, что при выборе в качестве
Эти выражения представляют собой уравнения
Формула (2) определяет Э. лишь с точностью
здесь ведётся вдоль пути любого квазистатич. процесса, связывающего состояния
Л я В, при этом, согласно равенству Клаузиуса, приращение Э. &S
= = S
следует, что существует однозначная функция состояния S, к-рая при квази-статич.
адиабатных процессах (oQ = 0) остаётся постоянной. Процессы, в к-рых
Э. остаётся постоянной, наз. и з о э н тропийными. Примером может служить
процесс, широко используемый для получения низких темп-р,- адиабатное размагничивание
(см. Магнитное охлаждение). При изотермич. процессах изменение Э.
равно отношению сообщённой системе теплоты к абс. темп-ре. Напр., изменение
Э. при испарении жидкости равно отношению теплоты испарения к темп-ре испарения
при условии равновесия жидкости с её насыщенным паром.
(закону
сохранения энергии), SQ = = dU + pdV, т. е. сообщаемое системе количество
теплоты равно сумме приращения внутр. энергии dU
и совершаемой системой
работы pdV, где р -
давление, V - объём системы. С учётом
первого начала термодинамики дифференциальное определение Э. принимает
вид
![]()
независимых переменных внутренней энергии U и объёма
V
частные
производные Э. связаны с абс. темп-рой и давлением соотношениями:
![]()
состояния системы (первое - калорическое, второе - термическое). Уравнение
(4) лежит в основе определения абсолютной температуры,
(см. также
Температура,
Температурные шкалы).
до аддитивной постоянной (т. е. оставляет начало отсчёта Э. произвольным).
Абс. значение Э. позволяет установить третье начало термодинамики, или
Нернста теорему: при стремлении абс. темп-ры к нулю разность &S для
любого вещества стремится к нулю независимо от внешних параметров. Поэтому
Э.
всех
веществ при абс. нуле темп-ры можно принять равной нулю (эту формулировку
теоремы Нернста предложил в 1911 М. Планк). Основываясь на ней,
за начальную точку отсчёта Э. принимают S
Важность понятия Э. для анализа необратимых
(неравновесных) процессов также была показана впервые Клаузиусом. Для необратимых
процессов интеграл от приведённой теплоты oQ/Т по замкну-
тому пути всегда отрицателен
![]()
т. н. неравенство Клаузиуса). Это неравенство
- следствие теоремы Карно: кпд частично или полностью необратимого циклич.
процесса всегда меньше, чем кпд обратимого цикла. Из неравенства Клаузиуса
вытекает, что
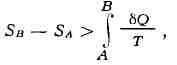 (6)
(6)
поэтому Э. адиабатически изолированной
системы при необратимых процессах может только возрастать.
Т. о., Э. определяет характер процессов
в адиабатич. системе: возможны только такие процессы, при к-рых Э. либо
остаётся неизменной (обратимые процессы), либо возрастает (необратимые
процессы). При этом не обязательно, чтобы возрастала Э. каждого из тел,
участвующего в процессе. Увеличивается общая сумма Э. тел, в к-рых процесс
вызвал изменения.
Термодинамич. равновесию адиабатич.
системы соответствует состояние с максимумом Э. Энтропия может иметь не
один, а неск. максимумов, при этом система будет иметь неск. состояний
равновесия. Равновесие, к-рому соответствует наибольший максимум Э., наз.
абсолютно устойчивым (стабильным). Из условия максимальности Э. адиабатические
системы в состоянии равновесия вытекает важное следствие: темп-pa всех
частей системы в состоянии равновесия одинакова.
Понятие "Э." применимо и к термодинамически
неравновесным состояниям, если отклонения от термодинамич. равновесия невелики
и можно ввести представление о локальном термодинамич. равновесии в малых,
но ещё макроскопич. объёмах. Такие состояния можно охарактеризовать термодинамич.
параметрами (темп-рой, давлением и т. д.), слабо зависящими от пространственных
координат и времени, а Э. термодинамически неравновесного состояния определить
как Э. равновесного состояния, характеризующегося теми же значениями параметров.
В целом Э. неравновесной системы равна сумме Э. её частей, находящихся
в локальном равновесии.
Термодинамика неравновесных процессов
позволяет
более детально, чем классическая термодинамика, исследовать процесс возрастания
Э. и вычислить количество Э., образующейся в единице объёма в единицу времени
вследствие отклонения системы от термодинамич. равновесия - производство
энтропии. Производство Э. всегда положительно и математически выражается
квадратичной формой от градиентов термодинамич. параметров (темп-ры, гидродинамич.
скорости или концентраций компонентов смеси) с коэффициентами, наз. кинетическими
(см. Онсагера теорема).
Статистич. физика связывает Э. с вероятностью
осуществления данного макроскопич. состояния системы. Э. определяется через
логарифм статистического веса О данного равновесного состояния
S = k In Q (Е, N), (7)
где k - Больцмана постоянная, О(Е,
N) - число квантовомеханич. уровней в узком интервале энергии &E
вблизи значения энергии Е системы из N частиц. Впервые связь Э.
с вероятностью состояния системы была установлена Л. Больцманом в
1872: возрастание Э. системы обусловлено её переходом из менее вероятного
состояния в более вероятное. Иными словами, эволюция замкнутой системы
осуществляется в направлении наиболее вероятного распределения энергии
по отдельным подсистемам.
В отличие от термодинамики статистич.
физика рассматривает особый класс процессов - флуктуации,
при к-рых
система переходит из более вероятного состояния в менее вероятное, и её
Э. уменьшается. Наличие флуктуации показывает, что закон возрастания Э.
выполняется только в среднем для достаточно большого промежутка времени.
Э. в статистич. физике тесно связана
при условии
Значение Ни равно нулю, если
Понятие Э., как показал впервые Э.
Э., характеризуя вероятность осуществления
Изотермич. сжатие вещества приводит
Формулу (11) применяют для практич.
В соответствии с (1) Э. измеряется
Э. увеличивается при переходе вещества
Чем выше твёрдость вещества, тем меньше
Э. аморфного тела несколько больше
Э. возрастает по мере усложнения молекулы
Э. простых веществ и соединений (напр.,
Знак изменения Э. при хим. реакции
М. X. Карапетъяпц.
Лит.: Клаузиус Р., в кн.: Второе
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
с информационной Э., к-рая служит мерой неопределённости сообщений данного
источника (сообщения описываются множеством величин x
соответствующих вероятностей p
величин x
Для определённого (дискретного) статистич. распределения вероятностей
р
Э. называют величину
![]()
![]() (8)
(8)
к.-л. из Pk равно 1, а остальные - нулю, т. е. неопределённость
в информации отсутствует. Э. принимает наибольшее значение, когда p
между собой и неопределённость в информации максимальна. Информационная
Э., как и термодинамич., обладает свойством аддитивности (Э. неск. сообщений
равна сумме Э. отдельных сообщений). К. Э. Шеннон показал, что Э.
источника информации определяет критич. значение скорости "помехоустойчивой"
передачи информации по конкретному каналу связи (см. Шеннона теорема).
Из
вероятностной трактовки информационной Э. могут быть выведены основные
распределения статистич. физики: каноническое Гиббса распределение,
к-рое
соответствует максимальному значению информационной Э. при заданной средней
энергии, и большое канонич. распределение Гиббса - при заданных средней
энергии и числа частиц в системе.
Шрёдингер
(1944),
существенно и для понимания явлений жизни. Живой организм с точки зрения
протекающих в нём физико-химич. процессов можно рассматривать как сложную
открытую
систему, находящуюся в неравновесном, но стационарном состоянии. Для
организмов характерна сбалансированность процессов, ведущих к росту Э.,
и процессов обмена, уменьшающих её. Однако жизнь не сводится к простой
совокупности физико-химич. процессов, ей свойственны сложные процессы саморегулирования.
Поэтому с помощью понятия Э. нельзя охарактеризовать жизнедеятельность
организмов в целом. Д. Н. Зубарев.
данного состояния системы, согласно (7) является мерой его неупорядоченности.
Изменение Э. &S обусловлено как изменением р, V и Т, так и процессами,
протекающими при р, Т = const и связанными с превращением веществ,
включая изменение их агрегатного состояния, растворение и хим. взаимодействие.
к уменьшению, а изотермич. расширение и нагревание - к увеличению его Э.,
что соответствует ур-ниям, вытекающим из первого и второго начал термодинамики
(см. Термодинамика):
![]() (9)
(9)
![]() <(11)
<(11)
определения абс. значения Э. при темп-ре Т, используя постулат Планка
и значения теплоёмкости С, теплот и температур фазовых переходов в интервале
от 0 до Т К.
в
кал/(моль • К) (энтропийная единица - э. е.) и дж/(моль * К).
При расчётах обычно применяют значения Э. в стандартном состоянии, чаще
всего при 298,15 К (25 °С), т. е. S
в состояние с большей энергией. &S сублимации >&S парообразования>>&S
плавления >&S полиморфного превращения. Напр., Э. воды в кристал-лич.
состоянии равна 11,5, в жидком - 16,75, в газообразном - 45,11 э. е.
его Э.; так, Э. алмаза (0,57 э. е.) вдвое меньше Э. графита (1,37 э. е.).
Карбиды, бориды и другие очень твёрдые вещества характеризуются небольшой
Э.
Э. кристаллического. Возрастание степени дисперсности системы также приводит
к нек-рому увеличению её Э.
вещества; так, для газов NiO, N
мол. массе Э. разветвлённых углеводородов меньше Э. неразветвлённых; Э.
циклоалкана
(циклана)
меньше Э. соответствующего ему алкена.
хлоридов АС1
Периодичность изменения Э. для сходных хим. реакций типа 1/п А
веществ, обусловленного различиями в их строении и составе, позволило разработать
методы приближённого расчёта Э.
&S
и абс. значение &S
процессы (&G < О, &Н < 0), протекающие с уменьшением Э. (&S
< 0). Такие процессы распространены, в частности, при растворении (напр.,
комплексообразование), что свидетельствует о важности химических взаимодействий
между участвующими в них веществами.
начало термодинамики, М. - Л., 1934, с. 71 - 158; Зоммерфельд А., Термодинамика
и статистическая физика, пер. с нем., М., 1955; М а и е р Д ж., Г е п п
е р т-М а и е р М., Статистическая механика, пер. с англ., М., 1952; Д
е Г р о о т С., М а з у р П., Неравновесная термодинамика, пер. с англ.,
М., 1964; Зубарев Д. Н., Неравновесная статистическая термодинамика, М.,
1971; Я гл о м А. М., Я т л о м И. М., Вероятность и информация,
3 изд., М., 1973; Б р и л л юе н Л., Наука и теория информации, пер. с
англ., М., 1959. См. также лит. при ст. Термодинамика, Термодинамика
неравновесных процессов п Статистическая физика.