ЭЛЕКТРОСИНТЕЗ
(от
электро...
и
синтез),
метод
получения сложных не-органич. или органич. соединений с помощью
электролиза.
Характерная
особенность Э.- многостадийность присоединения или отдачи электронов, связанная
с образованием промежуточных стабильных или нестабильных продуктов. Каждой
стадии Э. соответствует определённое значение электродного потенциала.
Многостадийные процессы Э. могут быть выражены
с помощью следующих ур-ний:
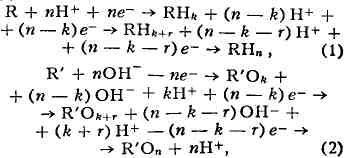
где R и R - исходные продукты; RH Реакции, выражаемые ур-нием (1), протекают
Если целевой продукт Э. образуется на промежуточной
С наибольшей эффективностью электровосстанавливаются
- хим. реакция,
- электрохимич. реакция, где К - исходный
Роль электролиза в данном случае сводится
Э. находит практич. применение для получения
В пром-сти применяют способ получения надсернрй
Э. применяется и при получении различных
Электрохимич. фторирование используется
Лит.: Прикладная электрохимия, под
Павлов В. П., Электролиз в неорганической
М. Я. Фиошин.
(е-),
участвующих
в электрохимич. реакциях.
на катоде и наз. реакциями электровосстановления, или электрохимич. восстановления.
Реакции, выражаемые ур-нием (2), протекают на аноде и наз. реакциями электроокислени
я, или электрохимич. окисления. Промежуточные и конечные продукты могут
принимать участие в различных электрохимич. реакциях на поверхности электродов.
стадии, то электролиз необходимо проводить при контролируемом электродном
потенциале, соответствующем данной стадии. Продукт можно быстро выводить
из сферы реакции путём отгонки, экстракции или связывания в соединение,
не вступающее в электрохимич. превращения. Выход продукта Э. может изменяться
и в результате различных хим. реакций в объёме растворах с участием промежуточных,
исходных и конечных веществ. Напр., нек-рые окислители, получаемые на аноде,
могут разлагаться в объёме раствора с потерей активного кислорода, гидролизоваться,
диспропорционировать и т. д. Роль хим. реакций в объёме раствора учитывается
по объёмной плотности тока, или концентрации тока. Эта величина определяется
как сила тока, проходящего через единицу объёма электролита, и выражается
в а/л. Процессы Э., в к-рых хим. реакции в объёме раствора приводят
к уменьшению выхода целевого продукта, должны проводиться с высокими объёмными
плотностями тока (до нескольких сотен а/л).
или электроокис-ляются исходные вещества, диссоциированные в растворе на
ионы, а также органич. соединения, имеющие полярные функциональные группы.
Нейтральные молекулы органич. веществ во мн. случаях не обладают достаточной
реакционной способностью и не вступают в реакции на поверхности электрода.
В этом случае применяются методы непрямого электровосстановления или электроокисления,
осуществляемые в объёме раствора посредством катализаторов-переносчиков,
в качестве к-рых используются ионы металлов или неметаллов переменной валентности.
Процесс в общем виде может быть описан следующими ур-ниями:
![]()
![]()
продукт, К - катализатор-переносчик, С - конечный продукт, z - степень
окисления, п - число электронов (е-), участвующих в реакции.
к регенерации на электродах хим. восстановителя или окислителя, к-рые при
взаимодействии с исходным веществом в электролизе или вне его превращают
это вещество в целевой продукт.
ряда ценных неорганич. и органич. соединений. Путём электроокисления синтезируют,
напр., кислородсодержащие соединения хлора в различных степенях окисления.
(пероксодисерной) кислоты и её солей - персульфатов (см. Пер-оксосулъфаты),
основанный
на электроокислении серной кислоты и сульфатов. Надсерная кислота и часть
её солей используются при произ-ве перекиси водорода. Перманганат калия
получают электроокислением манганата или анодным растворением сплавов марганца
с железом - ферромарганца. Двуокись марганца в значит, масштабах производится
электролизом сернокислых растворов сульфата марганца.
органич. соединений (см. Колъбе реакция).
для пром. получения ряда перфтороорганических соединений. Электрохимич.
методом получают тетраэтилсвинец и мн. др. вещества.
ред. А. Л. Ротиняна, 3 изд., Л., 1974; Ф и о ш и н М. Я., Успехи в области
электросинтеза неорганических соединений, М., 1974; Прикладная электрохимия,
под ред. Н. Т. Кудрявцева, 2 изд., М.., 1975; Т о м и л о в А. П., Ф и
о ш и н М. Я., Смирнов В. А., Электрохимический синтез органических вещесгв,
Л., 1976; Фиошин М.Я.,
химии, М., 1976; Электрохимия органических соединений, пер. с англ., М.,
1976.
А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Ъ Ы Ь Э Ю Я