ФОСФОР
(лат. Phosphorus),
Историческая справка. По
Распространение в природе.
Физические свойства. Элементарный
Белый Ф.- воскообразное,
При нагревании белого Ф.
Атомный радиус Ф. 1,34 А,
Атомы Ф. объединяются в двухатомные
Химические свойства. Конфигурация
Ф. химически активен, наибольшей
Ф. непосредственно соединяется
P из которых только P При темп-pax выше 2000°С
Ф. образует многочисленные
Получение. Произ-во элементарного
2Са = P Пары Ф. выходят из электропечи
Разрабатываются методы получения
Применение. Осн. масса производимого
Белый Ф. используется в зажигательных
Техника безопасности. Белый
Ф. в организме. Ф.- один
мы Ф., подобно атомам серы,
к различным органич.
Содержание Ф. (в мг на
Н. Н. Чернов.
Отравления Ф. и его соединениями
Лекарственные препараты,
Лит.: Краткая химическая
Дж., Современная неорганическая
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
P, хим. элемент V группы периодич. системы Менделеева, ат. н. 15, ат. м.
30,97376, неметалл. Природный Ф. состоит из одного стабильного изотопа
31Р;
получено шесть искусственных радиоактивных изотопов: 28Р (Т
(Т
33Р(Т
значительной энергией в-излучения и применяемый в хим. и биохим. исследованиях
в качестве меченого атома.
нек-рым лит. данным, способ получения Ф. был известен ещё араб. алхимикам
12 в. Но общепринятой датой открытия Ф. считается 1669, когда X. Бранд
(Германия) при прокаливании с песком сухого остатка от выпаривания мочи
и последующей перегонкой без доступа воздуха получил светящееся в темноте
вещество, названное сначала "холодным огнём", а позднее Ф. от греч. phosphoros
- светоносный. Вскоре способ получения Ф. стал известен нем. химикам -
И. Крафту, И. Кункелю; в 1682 об этом способе было опубликовано. В 1743
А. С. Маргграф разработал след. способ получения Ф.: смесь хлорида
свинца с мочой выпаривалась досуха и нагревалась до прекращения выделения
летучих продуктов; остаток смешивали с древесным углём в порошке и подвергали
перегонке в глиняной реторте; пары Ф. конденсировались в приёмнике с водой.
Наиболее простой метод получения Ф. прокаливанием костяной золы с углём
был предложен лишь в 1771 К. Шееле. Элементарную природу Ф. установил
А. Лавуазье. Во 2-й пол. 19 в. возникло пром. произ-во Ф. из фосфоритов
в ретортных печах; в нач. 20 в. они были заменены электрич. печами.
Ср. содержание Ф. в земной коре (кларк) - 9,3*10-2 % по массе;
в средних горных породах 1,6*10-1, в основных породах 1,4*10-1,
меньше в гранитах и др. кислых изверженных породах - 7*10-2
и ещё меньше в ультраосновных породах (мантии)-1,7*102 %; в
осадочных горных породах от 1,7*10-2 (песчаники) до 4*10-2
%
(карбонатные породы). Ф. принимает участие в маг-матич. процессах и энергично
мигрирует в биосфере. С обоими процессами связаны его крупные накопления,
образующие пром. месторождения апатитов и фосфоритов
(см.
Фосфатные
руды). Ф.- исключительно важный биогенный элемент,
он накапливается
мн. организмами. С биогенной миграцией связаны мн. процессы концентрации
Ф. в земной коре. Из вод Ф. легко осаждается в виде нерастворимых минералов
или захватывается живым веществом. Поэтому в мор. воде лишь 7*10-6
% Ф. Известно ок. 180 минералов Ф., в основном - это различные фосфаты,
из к-рых наиболее распространены фосфаты кальция (см. Фосфаты природные).
Ф. существует в виде нескольких аллотропич. модификаций, гл. из к-рых -
белая, красная и чёрная.
прозрачное вещество с характерным запахом, образуется при конденсации паров
Ф. Белый Ф. в присутствии примесей -следов красного Ф., мышьяка, железа
и т. п.- окрашен в жёлтый цвет, поэтому товарный белый Ф. наз. жёлтым.
Существуют две формы белого Ф.: а- и В-форма. а-Модификация представляет
собой кристаллы кубич. системы (а =18,5 А); плотность 1,828 г/см3,
t
пара при 25 0С 5,7 н/м2 (0,043 мм рт. ст.).
Коэфф.
линейного расширения в интервале темп-р от 0 до 44 °С равен 12,4*10-4,
теплопроводность 0,56 вт/(м • К) [1,1346 • 10-3 кал.(см
• сек • °С)] при 25 0С. По электрич. свойствам а-белый Ф.
близок к диэлектрикам: ширина запрещённой зоны ок. 2,1 эв, удельное
электросопротивление 1,54*1011 ом*см,
диамагнитен, удельная
магнитная восприимчивость -0,86 • 10-6. Твёрдость по Бринеллю
6 Мн/м2 (0,6 кгс/мм2).
а-Форма белого
Ф. хорошо растворяется в сероуглероде, хуже - в жидком аммиаке, бензоле,
четырёххлористом углероде и др. При -76,9 °С и давлении 0,1 Мн/м2(1
кгс/см2) a-форма переходит в низкотемпературную В-форму
(плотность 1,88 г /см3). С повышением давления до 1200
Мн/м2 (12 тыс. кгс/см2) переход происходит
при 64,5 °С. В-Форма - кристаллы с двойным лучепреломлением, их структура
окончательно не установлена. Белый Ф. ядовит: на воздухе при темп-ре ок.
40 °С самовоспламеняется, поэтому его следует хранить под водой (растворимость
в воде при 25 0С 3,3*10-4 %). Нагреванием белого
Ф. без доступа воздуха при 250-300 °С в течение нескольких часов получают
красный Ф. Переход экзотермичен, ускоряется ультрафиолетовыми лучами, а
также примесями (иод, натрий, селен). Обычный товарный красный Ф. практически
полностью аморфен; имеет цвет от тёмно-коричневого до фиолетового. При
длительном нагревании необратимо может переходить в одну из кристаллических
форм (триклинную, кубич. и др.) с различными свойствами: плотностью от
2,0 до 2,4 г/см3, t
при давлении в несколько десятков атмосфер, темп-рой возгонки от 416 до
423 °С, удельным электросопротивлением от 109 до 1014ом*см.
Красный
Ф. на воздухе не самовоспламеняется, вплоть до температуры 240-250 °С,
но самовоспламеняется при трении или ударе; нерастворим в воде, а также
в бензоле, сероуглероде и др., растворим в трибромиде Ф. При темп-ре возгонки
красный Ф. превращается в пар, при охлаждении к-рого образуется в основном
белый Ф.
до 200- 220 °С под давлением (1,2-1,7). 103 Мн/м2 [(12-17)-103кгс/смг]
образуется
чёрный Ф. Это превращение можно осуществить без давления, но в присутствии
ртути и небольшого кол-ва кристаллов чёрного Ф. (затравки) при 370 °С в
течение 8 сут. Чёрный Ф. представляет собой кристаллы ромбич. структуры
(а = 3,31 А, b = 4,38 А, с = 10,50 А), решётка построена
из волокнистых слоев с характерным для Ф. пирамидальным расположением атомов,
плотность 2,69 г/см3, t
под давлением 1,8*103Мн/м2(18*103
кгс/см2). По внешнему виду чёрный Ф. похож на графит;
полупроводник: ширина запрещённой зоны 0,33 эв при 25 0С;
имеет удельное электросопротивление 1,5 ом*см, температурный коэфф.
электросопротивления 0,0077, диамагнитен, удельная магнитная восприимчивость
-0,27*10-6. При нагревании до 560-580 °С под давлением собств.
паров превращается в красный Ф. Чёрный Ф. малоактивен, с трудом воспламеняется
при поджигании, поэтому его можно безопасно подвергать механич. обработке
на воздухе.
ионные радиусы: Р5+ 0,35 А, Р3+ 0,44 А, Р3-1,86
А.
(Р
Наиболее стабильны при нормальных условиях полимерные молекулы, содержащие
длинные цепи связанных между собой P
жидком, твёрдом виде (белый Ф.) и в парах ниже 800 °С Ф. состоит из молекул
P
При темп-pax выше 800 °С молекулы P
Только белый Ф. состоит из молекул Р
внешних электронов атома Ф. 3s23p3; в соединениях
наиболее характерны степени окисления +5, +3, и -3. Подобно азоту, Ф. в
соединениях гл. обр. ковалентен. Ионных соединений, подобных фосфидам Na
увеличения координационного числа и образованию донорно-акцепторных связей.
активностью обладает белый Ф.; красный и чёрный Ф. в хим. реакциях гораздо
пассивнее. Окисление белого Ф. происходит по механизму цепных реакций.
Окисление
Ф. обычно сопровождается хемилюминесценцией. При горении Ф. в избытке кислорода
образуется пя-тиокись Р
окислов.
Ф. в избытке сухого воздуха. Последующая гидратация Р
кислоту Н
фосфорноватистую
кислоту Н
степени - фосфиты и гипофосфиты.
со всеми галогенами с выделением большого кол-ва тепла и образованием тригалоге-нидов
(РХ
сплавлении Ф. с серой ниже 100 °С образуются твёрдые растворы на основе
Ф. и серы, а выше 100 °С происходит эк-зотермич. реакция образования кристаллич.сульфидов
РН
P
электрич. дугу; полимерные фосфони-трилгалогениды - (PNX
с аммиаком при различных условиях; амидо-имидофосфаты - соединения, как
правило, полимерные, содержащие наряду с Р-О-Р связями Р-NH-Р связи.
Ф. реагирует с углеродом с образованием карбида РС
к-тами, ни со щелочами. При нагревании с металлами Ф. образует фосфиды.
фосфорорганические
соединения.
Ф. осуществляется электротермич. восстановлением его из природных фосфатов
(апатитов или фосфоритов) при 1400-1600 °С коксом в присутствии кремнезёма
(кварцевого песка):
в электропечь. Кремнезём необходим для снижения темп-ры реакции, а также
увеличения её скорости за счёт связывания выделяющейся в процессе восстановления
окиси кальция в силикат кальция, к-рый непрерывно удаляется в виде расплавленного
шлака. В шлак переходят также силикаты и окислы алюминия, магния, железа
и др. примеси, а. также ферро-фосфор (Fe
а также растворённые в нём небольшие кол-ва фосфидов марганца и др. металлов
по мере накопления удаляются из электропечи с целью последующего использования
при произ-ве специальных сталей.
вместе с газообразными побочными продуктами и летучими примесями (СО, SiF
направляют в конденсационные установки, в которых при темп-ре не ниже 50
0С
собирают под водой жидкий технич. белый Ф.
Ф. с применением газообразных восстановителей, плазменных реакторов с целью
интенсификации произ-ва за счёт повышения темп-р до 2500-3000 °С, т. е.
выше темп-р диссоциации природных фосфатов и газов-восстановителей (напр.,
метана), используемых в качестве транспортирующего газа в низкотемпературной
плазме.
Ф. перерабатывается в фосфорную кислоту и получаемые на её основе
фосфорные
удобрения и технич. соли (фосфаты).
и дымовых снарядах, бомбах; красный Ф.- в спичечном произ-ве. Ф. применяется
в произ-ве сплавов цветных металлов как раскислитель. Введение до 1% Ф.
увеличивает жаропрочность таких сплавов, как фехраль, хромаль. Ф. входит
в состав нек-рых бронз, т. к. повышает их жидкотекучесть и стойкость против
истирания. Фосфиды металлов, а также нек-рых неметаллов (В, Si, As и т.
п.) используются при получении и легировании полупроводниковых материалов.
Частично
.Ф. применяется для получения хлоридов и сульфидов, к-рые служат исходными
веществами для произ-ва фосфорсодержащих пластификаторов
(напр.,
трикрезилфосфат, трибутилфосфат и др.), медикаментов, фосфорорганических
пестицидов, а также применяются в качестве добавок в смазочные вещества
и в горючее.
Ф. и его соединения высокотоксичны. Работа с Ф. требует тщательной герметизации
аппаратуры; хранить белый Ф. следует под водой или в герметически закрытой
металлич. таре. При работе с Ф. следует строго соблюдать правила техники
безопасности. Л. В. Кубасова.
из важнейших биогенных элементов, необходимый для жизнедеятельности
всех организмов. Присутствует в живых клетках в виде орто- и пирофосфорной
к-т и,их производных, а также входит в состав нуклеотидов, нуклеиновых
кислот, фосфопротеидов, фосфолипидов, фосфорных эфиров углеводов,
мн. кофер-ментов и др. органич. соединений. Благодаря особенностям хим.
строения ато-
способны к образованию богатых энергией связей в макроэргических соединениях:
адено-зинтрифосфорной
к-те (АТФ), креа-тинфосфате и др. (см. Окислительное фосфорилирование).
В
процессе биол. эволюции именно фосфорные соединения стали основными, универсальными
хранителями генетич. информации и переносчиками энергии во всех живых системах.
Др. важная роль соединений Ф. в организме заключается в том, что ферментативное
присоединение фосфорильного остатка
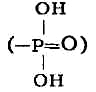
соединениям (фосфорилирование) служит как бы "пропуском" для их
участия в обмене веществ, и, наоборот, отщепление фосфорильного
остатка (де-фосфорилирование) исключает эти соединения из активного обмена.
Ферменты обмена Ф.- киназы, фосфорилазы и фосфатазы. Гл.
роль в превращениях соединений Ф. в организме животных и человека играет
печень. Обмен фосфорных соединений регулируется гормонами и витамином D.
100 г сухого вещества) в тканях растений - 230-350, мор. животных
- 400-1800, наземных - 1700-4400, у бактерий - около 3000; в организме
человека особенно много Ф. в костной ткани (неск. более 5000), в тканях
мозга (ок. 4000) и в мышцах (220-270). Суточная потребность человека в
Ф. 1-1,2 г (у детей она выше, чем у взрослых). Из продуктов питания
наиболее богаты Ф. сыр, мясо, яйца, зерно бобовых культур (горох, фасоль
и др.). Баланс Ф. в организме зависит от общего состояния обмена веществ.
Нарушение фосфорного обмена приводит к глубоким биохим. изменениям, в первую
очередь в энергетическом обмене. При недостатке Ф. в организме у животных
и человека развиваются остеопороз и др. заболевания костей, у растений
- фосфорное голодание (см. Диагностика питания растений). Источником
Ф. в живой природе служат его неорганич. соединения, содержащиеся в почве
и растворённые в воде. Из почвы Ф. извлекается растениями в виде растворимых
фосфатов. Животные обычно получают достаточное кол-во Ф. с пищей. После
гибели организмов Ф. вновь поступает в почву и донные отложения, участвуя
т. о. в круговороте веществ. Важная роль Ф. в регуляции обменных
процессов обусловливает высокую чувствительность мн. ферментных систем
живых клеток к действию фосфорорганич. соединений. Это обстоятельство используют
в медицине при разработке лечебных препаратов, в с. х-ве при произ-ве фосфорных
удобрений, а также при создании эффективных инсектицидов. Мн.
соединения Ф. чрезвычайно токсичны и нек-рые из фосфорорганич. соединений
могут быть причислены к боевым отравляющим веществам (зарин, зоман, табун).
Радиоактивный изотоп Ф. 32Р широко используют в биологии и медицине
как индикатор при исследовании всех видов обмена веществ и энергии в живых
организмах (см. Изотопные индикаторы).
наблюдаются при их термоэле-ктрич. возгонке, работе с белым Ф., произ-ве
и применении фосфорных соединений. Высокотоксичны фосфорорганические
соединения, оказывающие анти-холинэстеразное действие. Ф. проникает
в организм через органы дыхания, желудочно-кишечный тракт, кожу. Острые
отравления проявляются жжением во рту и желудке, головной болью, слабостью,
тошнотой, рвотой. Через 2-3 сут возникают боли в подложечной области,
правом подреберье, желтуха. Для хро-нич. отравлений характерны воспаление
слизистых оболочек верх. дыхательных путей, признаки токсич. гепатита,
нарушение кальциевого обмена (развитие остеопороза, ломкость, иногда
омертвение костной ткани, чаще - на ниж. челюсти), поражение сердечно-сосудистой
и нервной систем. Первая помощь при остром отравлении через рот (наиболее
частом) - промывание желудка, слабительное, очистительные клизмы, внутривенно
растворы глюкозы, хлористого кальция и др. При ожогах кожи - обработать
поражённые участки растворами медного купороса или соды. Глаза промывают
2%-ным раствором питьевой соды. Профилактика: соблюдение правил техники
безопасности, личная гигиена, уход за полостью рта, раз в 6 мес - мед.
осмотры работающих с Ф.
содержащие Ф. (аденозинтрифосфорная кислота, фитин, глицерофосфат кальция,
фосфрен и др.), влияют гл. обр. на процессы тканевого обмена и применяются
при заболеваниях мышц, нервной системы, при туберкулёзе, упадке питания,
малокровии и др. Радиоактивные изотопы Ф. используют в качестве изотопных
индикаторов для изучения обмена веществ, диагностики заболеваний, а
также для лучевой терапии опухолей (см. также Радиоактивные препараты).
А. А. Каспаров.
энциклопедия, т. 5, М., 1967; Коттон Ф., Уилкинсон
химия, пер. с англ., ч. 2, М., 1969; Везер В а н - Д ж., Фосфор и его соединения,
пер. с англ., т. 1, М., 1962; Ахметов Н. С., Неорганическая химия, 2 изд.,
М., 1975; Некрасов Б. В., Основы общей химии, 3 изд., т. 1-2, М., 1973;
Моссэ А. Л., Печковский В. В., Применение низкотемпературной плазмы в технологии
неорганических веществ, Минск, 1973; Горизонты биохимии, Сб. ст., пер.
с англ., М., 1964; Рапопорт С. М., Медицинская биохимия, пер. с нем., М.,
1966; Скулачев В. П., Аккумуляция энергии в клетке, М., 1969; Происхождение
жизни и эволюционная биохимия, М., 1975.