УРАВНЕНИЕ СОСТОЯНИЯ
связывает
Примерами У. с. для газов
зависящие от природы газа
Для равновесного излучения,
Для жидкостей из-за сложности
Для твёрдых тел термич. У.
Для магнитных сред элементарная
Для электрически поляризуемых
Лит.: Хилл Т., Статистическая
Д. Н. Зубарев.
давление р, объём V и температуру Т физически однородной
системы в состоянии равновесия термодинамического: f(p, V, T)= 0.
Это уравнение наз. термическим У. с., в отличие от калорического У. с.,
определяющего внутреннюю энергию системы U как функцию к.-л.
двух из трёх параметров р, V, Т. Термич. У. с. позволяет выразить
давление через объём и темп-ру р = p(V, Т) и определить элементарную
работу бА = pбV при бесконечно малом расширении системы бV.
У. с. является необходимым дополнением к термодина-мич. законам, к-рое
делает возможным их применение к реальным веществам. Оно не может быть
выведено с помощью одних только законов термодинамики, а определяется
или рассчитывается теоретически на основе представлений о строении вещества
методами статистической физики. Из первого начала термодинамики
следует
лишь существование калорич. У. с., а из второго начала термодинамики
- связь между термич. и калорич. У. с. (дU/дV)
T(дp/дT)v
- р, откуда вытекает, что для идеального газа внутр. энергия
не зависит от объёма (дU/дV)
что для вычисления как термич., так и калорич. У. с., достаточно знать
любой из потенциалов термодинамических в виде функции своих параметров.
Напр., если известна Гельмгольцева энергия F как функция Г и V,
то У. с. находят дифференцированием:
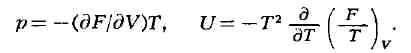
может служить Клапейрона уравнение для идеального газа pv=RT,
где
R - газовая постоянная, v - объём 1 моля газа;
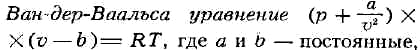
и учитывающие влияние сил притяжения между молекулами и конечность из объёма,
в и-риальное У. с. для неидеального газа рv/RT = 1 + B(T)/v + C(T)/v2
+ ..., где В(Т), С(T)... - 2-й, 3-й и т. д. ви-риальные коэфф.,
зависящие от сил взаимодействия между молекулами (см. Газы). Это
уравнение является наиболее надёжным и теоретически обоснованным У. с.
для газов и позволяет объяснить многочисленные экспериментальные результаты
на основании простых моделей межмолекулярного взаимодействия. Были
предложены также различные эм-пирич. У. с., основанные на экспериментальных
данных о теплоёмкости и сжимаемости. У. с. неидеальных газов указывает
на существование критич. точки (с параметрами p
(см. Критическое состояние). Если У. с. представить в виде приведённого
У. с., т. е. в безразмерных переменных р/рк, V/V
при не слишком низких темп-pax это уравнение мало меняется для различных
веществ (закон соответственных состояний).
или фотонного газа, У. с. определяется Планка законом излучения для
средней плотности энергии.
учёта всех особенностей взаимодействия молекул пока не удалось теоретически
получить общее У. с. Уравнение Ван-дер-Ваальса хотя и применяют для качественной
оценки поведения жидкостей, но оно по существу неприменимо ниже критич.
точки, когда возможно сосуществование жидкой и газообразной фаз. У. с.,
хорошо описывающее свойства ряда простых жидкостей, можно получить из приближённых
теорий жидкого состояния типа теории свободного объёма или дырочной теории
(см. Жидкость). Знание распределения вероятности взаимного расположения
молекул (парной корреляционной функции) принципиально позволяет вычислить
У. с. жидкости, но эта задача очень сложна и полностью ещё не решена даже
с помощью вычислит. машин.
с. определяет зависимость модулей упругости от темп-ры и давления.
Оно может быть получено на основании теории теплового движения в кристаллах,
рассматривающей фононы и их взаимодействие, но пока общего У. с.
для твёрдых тел не найдено.
работа при намагничивании равна бА = -HбM, где М - магнитный
момент, Н - напряжённость магнитного поля. Следовательно, зависимость
М
= М(Н,Т) представляет собой магнитное У. с.
сред элементарная работа при поляризации равна бА = -ЕбР, где
Р - поляризация, Е - напряжённость электрич. поля, следовательно,
У. с. имеет вид Р = Р(Е, Т).
механика, пер. с англ., М., 1960; Вукалович М. П., Новиков И. И., Уравнение
состояния реальных газов, М. -Л., 1948; Мейсон Э., СперлингТ., Вириальное
уравнение состояния, пер. с англ., М., 1972; Лейбфрид Г., Людвиг В., Теория
ангармонических эффектов в кристаллах, пер. с англ., М., 1963. См. также
лит. при статьях Статистическая физика и Термодинамика.
А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Ъ Ы Ь Э Ю Я