ТРОЙНЫЕ СИСТЕМЫ
трёхкомпонентные
системы, физикохимические системы, состоящие из трёх компонентов. Примерами
практически важных Т. с. являются металлические сплавы, а также
сплавы солей, окислов (шлаки), сульфидов (штейны), системы
из воды и 2 солей с общим ионом. Согласно фаз правилу, вариантность
(число термодинамич. степеней свободы) конденсированных Т. с. (не
содержащих газообразной фазы) при постоянном давлении определяется
выражением v = 4-ф, где ф - число фаз системы. Чтобы получить представление
о характере взаимодействия компонентов и практич. применении Т. с., необходимо
знать их диаграммы состояния и диаграммы состав - свойство.
Состояние Т. с. однозначно определяется
(при постоянном давлении) 3 переменными: темп-рой Т и концентрациями
2 компонентов (концентрация третьего компонента определяется из условия
x + у + z = 100, где x, у, z - концентрации
компонентов). Концентрации обычно выражают в процентах (атомных,
молекулярных, по массе). Следовательно, для изображения диаграмм
состояния T. с. необходимо трёхмерное пространство: два измерения служат,
чтобы показать изменения состава, а третье показывает изменение темп-ры
фазовых превращений (или свойств). Темп-ру (или величину свойства)
откладывают по вертикальной оси; для указания состава Т. с. обычно
применяют равносторонний треугольник, к-рый наз. концентрационным (рис.
1). Его вершины А, В, С соответствуют чистым компонентам
А,В, С. Каждая сторона треугольника разделенана 100 равных частей.
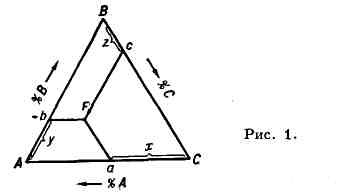
Составы двойных систем А - В, В - С
и А - С изображают точками на сторонах АВ, ВС и АС, а составы
Т.е.- точками F внутри треугольника ЛВС. Способы определения состава
в точке F основаны на геометрич. свойствах равносторонних треугольников:
напр. прямые Fa, Fb и Fc, параллельные соответственно сторонам
ВС, АС и АВ, отсекают отрезки Са, Аb и Вс,
сумма к-рых равна стороне треугольника. Точке F на рис. 1 соответствует
х%А, у% В и z% С.
Трёхмерные диаграммы состояния Т. с.
В точке Е число сосуществующих
Пользоваться объёмным изображением
Рис. 2.
Рис. 3.
Подобным же образом можно проследить
Экспериментальное построение полных
Лит.: Курнаков Н. С., Избр.
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
представляют в виде трёхгранных призм, ограниченных сверху сложными поверхностями
ликвидуса, являющимися геометрическим местом точек, каждая из к-рых соответствует
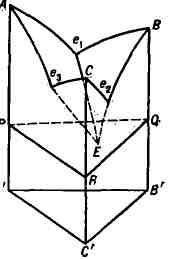
темп-ре начала кристаллизации. На рис. 2 показан простейший пример диаграммы
состояния Т. с. А - В - С, компоненты к-рой не образуют между собой хим.
соединений, неограниченно взаимно растворимы в жидком состоянии и не способны
к полиморфным превращениям. Двойные системы А - В, В- , С и А - С с эвтектич.
точками е
на гранях призмы. Ликвидус состоит из поверхностей Ae
кристаллизации В) и Се
кристаллизации С). Плоскость PQR, проходящая через точку
тройной эвтектики Е параллельно основанию призмы, является солидусом
Т. с. (геометрич. местом точек , соответствующих температурам конца кристаллизации).
фаз, максимальное для Т. с., равно 4 (жидкость и кристаллы А, В, С),
а их равновесие нонвариантно (темп-pa кристаллизации и состав фаз постоянны).
диаграмм состояния Т. с. практически очень неудобно, поэтому применяют
ортогональные проекции и сечения: горизонтальные - изотермические и вертикальные
- политермические (см. Физико-химический анализ). На рис. 3 показана
проекция диаграммы рис. 2 на плоскость треугольника А'В'С'. На ней
3 поверхности ликвидуса изображаются 3 полями кристаллизации Ae'
указывают направления понижения темп-р. Рассмотрим последовательность выделения
твёрдых фаз в поле Ae'
лежит на прямой А'Е', то из жидкой фазы при охлаждении выпадают
кристаллы А, причём отношение концентраций В и С остаётся постоянным.
В результате, когда состав Т. с. достигнет точки Е', начинается совместная
кристаллизация компонентов А, В и С при постоянной темп-ре (так как при
4 фазах и постоянном давлении Т. с. нонвариантна). Если точка F
А, затем, когда состав жидкой фазы дойдёт до точки f
кривой e
закончится в точке Е'. Итак, последовательность кристаллизации жидкой фазы
состава F
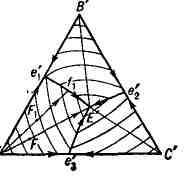
ход кристаллизации любой жидкой фазы системы А-В- С. На той же проекции
наносят изотермы начала кристаллизации (показаны тонкими линиями).
Вертикальные сечения более сложны, чем диаграммы двойных систем. Исключение
составляют так наз. квазибинарные сечения тех Т. с., где образуются двойные
и тройные соединения постоянного состава. Правила проведения таких сечений
(сингулярная триангуляция Т. с.), впервые сформулированные в 1925
Н. С. Курнаковым, позволяют упростить рассмотрение сложных Т. с.
диаграмм состояния Т. с. очень трудоёмко. Между тем для практич. целей
нередко достаточно построения боковых двойных систем и положения моновариантных
кривых, нонвариантных точек и областей распространения твёрдых растворов
на основе компонентов Т. с. В ряде случаев термодинамич. расчёты простейших
типов двойных и тройных диаграмм состояния дают результаты, близкие к экспериментальным
данным. Для расчётов равновесий в Т. с. используют различные упрощённые
модели; для решения сложных термодинамич. уравнений разработаны специальные
программы и применяется вычислительная техника.
труды, т. 1 - 3, М., 1960-63; Аносов В. Я., Погодин С. А., Основные начала
физико-химического анализа, М.-Л., 1947; Воловик Б. Е., 3ахаров М. В..
Тройные и четверные системы, М., 1948; Петров Д. А., Тройные системы, М.,
1953; Справочник по плавкости систем из безводных неорганических солей,
т. 1 - 2, М. - Л., 1961; Захаров А. М., Диаграммы состояний двойных и тройных
систем, М., 1964; Ванюков А. В., 3айцев В. Я., Шлаки и штейны цветной металлургии,
М., 1969; Крестовников А. Н., Вигдорович В. Н., Химическая термодинамика,
2 изд., М., 1973; Кауфман Л., Бернстейн X., Расчет диаграмм состояния с
помощью ЭВМ, пер. с англ., М., 1972; Диаграммы состояния металлических
систем, в. 1-18, М., 1959 - 75.