ТРОЙНАЯ СВЯЗЬ
химич. ковалентная
Если раньше в основном изучались Т.
Лит.: Шусторович Е. М., Химическая
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
связь, осуществляемая тремя парами электронов, находящихся в
поле двух атомных ядер. Т. с. включает одну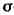
и две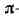 связи (см. Сигма-
связи (см. Сигма-
и пи-связи); результирующее распределение электронной плотности между
двумя связанными ядрами имеет осевую симметрию (как в случае простой
связи). В структурных формулах химич. соединений Т. с. между атомами
обозначается тремя валентными штрихами, напр.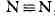
,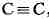
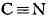 .
.
Если одна или обе я-компоненты Т. с. (напр., между атомами А и В) образуются
в результате донорно-акцепторного взаимодействия (см. Донорно-акцепторная
связь), такие Т. с.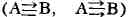 обычно
обычно
наз. квазитройными (в "нормальной" Т. с. А = В с- и две п-компоненты образованы
в результате взаимодействия неспаренных электронов). Примеры квазитройных
связей: связь концевого атома кислорода с атомом переходного металла (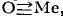 ,
,
т. н. "иловая" связь), напр. в K2[ReOCl
Вследствие большой энергии Т. с. и квазитройных связей соответствующие
молекулы (напр., N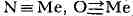 )термодинамически
)термодинамически
устойчивы и обычно химически инертны. Так, фиксация молекулярного азота
(т. е. активация его для химич. превращений) невозможна без предварит.
координации его как лиганда в определённых комплексах переходных металлов,
в результате к-рой кратность (прочность) связи азот - азот существенно
уменьшается.
с. между лёгкими атомами (С, N), то теперь всё большее внимание
уделяется Т. с. с участием тяжёлых атомов, прежде всего атомов переходных
металлов; эти тройные связи реализуются в новых типах комплексных соединений.
Уже изучено большое число комплексных соединений переходных металлов
с нитридо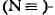 , оксо
, оксо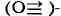
, имино и карбиновыми (RC
и карбиновыми (RC
=) группами как лигандами, характеризующимися высокой прочностью
химич. связей. Важной особенностью указанных лигандов является их сильное
трансвлияние (т. е. сильное ослабление связи металл - лиганд в транспозиции),
что предопределяет мн. свойства и реакционную способность таких соединений.
Кроме того, известны димерные кластеры переходных металлов с Т. с. металл
- металл, напр.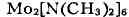 Эта молекула
Эта молекула
имеет центросимметричную повёрнутую (как в этане С
конфигурацию, что обусловлено осевой симметрией распределения электронной
плотности в связи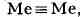 где Me - металл.
где Me - металл.
См. также Валентность, Химическая связь.
связь, М., 1973. Е. М. Шусторович.