СТАТИСТИЧЕСКАЯ ФИЗИКА
раздел физики,
задача к-рого-выразить свойства макроскопич. тел, т. е. систем, состоящих
из очень большого числа одинаковых частиц (молекул, атомов, электронов
и т. д.), через свойства этих частиц и взаимодействие между ними.
Изучением макроскопич. тел занимаются и
др. разделы физики - термодинамика, механика сплошных сред, электродинамика
сплошных сред. Однако при решении конкретных задач методами этих дисциплин
в соответствующие уравнения всегда входят неизвестные параметры или функции,
характеризующие данное тело. Так, для решения задач гидродинамики необходимо
знать уравнение состояния жидкости или газа, т. е. зависимость плотности
от темп-ры и давления, теплоёмкость жидкости, её коэфф. вязкости и т. п.
Все эти зависимости и параметры можно, разумеется, определять экспериментально,
поэтому методы, о к-рых идёт речь, наз. феноменологическими. Статистическая
же физика позволяет, по крайней мере в принципе, а во многих случаях и
фактически, вычислить все эти величины, если известны силы взаимодействия
между молекулами. T. о., С. ф. использует сведения о "микроскопическом"
строении тел - о том, из каких частиц они состоят, как эти частицы взаимодействуют,
поэтому её называют микроскопической теорией.
Если в какой-то момент времени заданы координаты
и скорости всех частиц тела и известен закон их взаимодействия, то, решая
уравнения механики, можно было бы найти эти координаты и скорости в любой
последующий момент времени и тем самым полностью определить состояние исследуемого
тела. (Для простоты изложение ведётся на языке классич. механики. Но и
в квантовой механике ситуация та же: зная начальную волновую
функцию системы и закон взаимодействия частиц, можно, решая Шрёдингера
уравнение, найти волновую функцию, определяющую состояние системы во
все будущие моменты времени.) Фактически, однако, такой путь построения
микроскопич. теории невозможен, т. к. число частиц в макроскопич. телах
очень велико. Напр., в 1 см3 газа при темп-ре О 0C
и давлении в 1 атм содержится примерно 2,7 ·1019 молекул.
Невозможно решить такое число уравнений, а начальные координаты и скорости
всех молекул всё равно неизвестны.
Однако именно большое число частиц в макроскопич.
телах приводит к появлению новых - статистических -закономерностей в поведении
таких тел. Это поведение в широких пределах не зависит от конкретных начальных
условий - от точных значений начальных координат и скоростей частиц. Важнейшее
проявление этой независимости - известный из опыта факт, что система, предоставленная
самой себе, т. е. изолированная от внеш. воздействий, с течением времени
приходит в нек-рое равновесное состояние (термодинамическое, или статистическое,
равновесие), свойства к-рого определяются только такими общими характеристиками
начального состояния, как число частиц, их суммарная энергия и т. п. (см.
Равновесие
термодинамическое). В дальнейшем речь будет идти главным образом о
С. ф. равновесных состояний.
Прежде чем сформулировать теорию, описывающую
статистич. закономерности, следует разумно ограничить сами требования к
теории. Именно, задачей теории должно являться вычисление не точных значений
различных физ. величин для макроскопич. тел, а ср. значений этих величин
по времени. Рассмотрим, напр., молекулы, находящиеся в нек-ром выделенном
в газе достаточно большом - макроскопическом - объёме. Число таких молекул
с течением времени будет меняться из-за их движения, и его можно было бы
найти точно, если были бы известны все координаты молекул во все моменты
времени. В этом, однако, нет необходимости. Изменение числа молекул в объёме
будет носить характер беспорядочных колебаний - флуктуации - относительно
нек-рого ср. значения. При большом числе частиц в объёме эти колебания
будут малы по сравнению со ср. числом частиц, так что для характеристики
макроскопич. состояния достаточно знать именно это ср. значение.
Для уяснения характера статистич. закономерностей
рассмотрим ещё один простой пример. Пусть в нек-рый сосуд помещено большое
число зёрен двух сортов, каждого сорта поровну, и содержимое сосуда тщательно
перемешано. Тогда на основании повседневного опыта можно быть уверенным,
что во взятой из сосуда пробе, содержащей всё ещё большое число зёрен,
будет обнаружено примерно равное число зёрен каждого сорта независимо от
того, в каком порядке засыпались зёрна в сосуд. На этом примере хорошо
видны два важных обстоятельства, обеспечивающих применимость статистич.
теории. Во первых, необходимость большого числа зёрен как во всей "системе"
- сосуде с зерном, так и в выбранной для опыта "подсистеме" - пробе. (Если
Проба состоит всего из двух зёрен, то нередко оба будут одного сорта.)
Во-вторых, ясно, что существ, роль играет сложность движения зёрен при
перемешивании, обеспечивающая их равномерное распределение в объёме сосуда.
<Функция распределения.
Рассмотрим
систему, состоящую из N частиц, для простоты считая, что частицы
не имеют внутр. степеней свободы. Такая система описывается заданием 6N
переменных
- 3N координат q
импульсов
PI частиц
[совокупность этих переменных сокращённо будет обозначаться
(p,q)]·
Вычислим
ср. значение по интервалу времени t нек-рой величины F (р, q), являющейся
функцией этих координат и импульсов. Для этого разобьём интервал (О,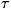 )
)
на s равных малых отрезков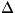 t
t
1,2,... .... s). Тогда по определению
![]()
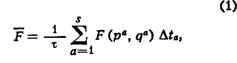
где qa и
рa
- значения координат и импульсов в моменты времени
t
пределе s-> бесконеч. сумма переходит в интеграл:
![]()
Понятие функции распределения ес-теств.
образом возникает, если рассмотреть пространство 6N измерений, на осях
к-рого отложены значения координат и импульсов частиц системы; оно наз.
фазовым пространством. Каждому значению времени ? соответствуют определённые
значения всех q к р, т. е. нек-рая точка в фазовом пространстве,
изображающая состояние системы в данный момент времени t. Разобьём всё
фазовое пространство на элементы, размер к-рых мал по сравнению с характерными
для данного состояния системы значениями q и р,
но ещё настолько
велик, что в каждом из них находится много точек, изображающих состояние
системы в различные моменты времени t. Тогда число таких точек в элементе
объёма будет примерно пропорционально величине этого объёма
dpdq.
Если
обозначить коэффициент пропорциональности через
sw(p, q), то это
число для элемента с центром в нек-рой точке (р, q) запишется в
виде:
![]()
где dpdq = dp переписать как F= (1/s)
(интегрирование по координатам производится
Из (3) и (4) видно, что wdpdq
Введённой таким образом функции распределения
Проведённые до сих пор рассуждения носили
При движении замкнутой системы не меняется
w(p,q) = A При выводе выражения (5) предполагалось,
Фактически обычно рассматриваются не замкнутые
Здесь H (р, q) - функция Гамильтона
w(p, q) = е[F-H(p,q)]/kT.(6)
Величина T в этой формуле имеет
Распределение (6) наз. каноническим распределением
Если тело состоит из двух невзаимодействующих
Формула (6) справедлива для систем, к-рые
В квантовой механике энергетич. спектр
причём условие нормировки Величина Z наз. статистической суммой системы;
Он отличается множителем от чисто классич.
Приведённые формулы относятся к случаю,
W в к-рой дополнит, параметр Статистическое истолкование термодинамики.
Далее, пусть функция Гамильтона системы
выражение E = интеграл Hwdpdq
Согласно сказанному выше, член, содержащий
Особое значение имеет статистич. истолкование
е-(F-E)/kT = С др._стороны, согласно термодинамике,
S = k1n Формула (8), связывающая свободную энергию
где H - напряжённость внеш. магнитного
Аналогично (8) условие нормировки в большом
Этот потенциал связан со свободной энергией
Приложения С. ф. к изучению тех или иных
Во многих случаях эта задача упрощается
где l - общее число постулат, и
замену переменных p = корень Tq Идеальный газ. Простейшим объектом исследования
где d3p = dp Статистич. сумма идеального газа также
где g - статистич. вес осн. состояния
а его хим. потенциал:
Характерно, что даже для невырожденного
выражения для свободной энергии и хим.
В случае двухатомных и многоатомных газов
kT> В этом случае в соответствии с законом
Рис. 1. Зависимость вращательной С В то же время характерные значения
Коэффициенты В, С и т. д. зависят от темп-ры
По порядку величины В
отклонений от идеальности существенно,
где N - число электронов,
(т. к. число электронов равно числу ионов,
Ещё один способ построения теории жидкости
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
объём выбранного элемента фазового пространства. Cp. значение (1) с учётом
малости этих элементов объёма можно
интегралFda,
т.е.
![]()
по всему объёму системы, по импульсам - от -беск. до +беск.). функция w(p,
q, t) носит название функции распределения по координатам и импульсам
частиц. Поскольку полное число выбранных точек равно s, функция
w
удовлетворяет
условию нормировки:
![]()
можно
рассматривать как вероятность системе находиться в элементе dpdq
фазового
пространства.
можно дать и др. истолкование. Для этого будем рассматривать одновременно
большое число одинаковых систем и примем, что каждая точка в фазовом пространстве
изображает состояние одной такой системы. Тогда усреднение по времени в
(1) - (1a) можно понимать как усреднение по совокупности этих систем, или,
как говорят, по статистическому ансамблю.
чисто формальный характер, т. к. нахождение функции распределения, согласно
(2), требует знания всех р и q во все моменты времени, т.
е. решения уравнений движения с соответствующими начальными условиями.
Осн. положением С. ф. является, однако, утверждение о возможности определить
эту функцию из общих соображений для системы, находящейся в состоянии термодинамич.
равновесия. Прежде всего можно показать, исходя из сохранения числа систем
при движении, что функция распределения является интегралом движения системы,
т. е. остаётся постоянной, если р и q меняются в соответствии с
уравнениями движения (см. Лиувилля теорема).
её энергия, поэтому все точки в фазовом пространстве, изображающие состояние
системы в разные моменты времени, должны лежать на нек-рой "гиперповерхности",
соответствующей начальному значению энергии E. Уравнение этой поверхности
имеет вид: Н(р, q) = Е, где H (р, q) - энергия системы, выраженная
через координаты и импульсы, т. е. её функция Гамильтона. Далее, движение
системы из многих частиц носит крайне запутанный характер. Поэтому с течением
времени точки, описывающие состояние, распределятся по поверхности постоянной
энергии равномерно, подобно тому как равномерно распределяются зёрна при
перемешивании в сосуде в упомянутом выше примере (см. также Эргодическая
гипотеза). Такое равномерное распределение по изоэнергетич. поверхности
описывается функцией распределения вида:
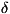 [H(p,q)-E],
[H(p,q)-E],
(5)
где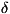 [Н (р, q)
[Н (р, q)
- E] - дельта-функция, отличная от нуля только при H=E, т. е.
на этой поверхности, А - постоянная, определяемая из условия нормировки
(4). Функция распределения (5), наз. микроканонической, позволяет вычислять
ср. значения всех физ. величин по формуле (3), не решая уравнений движения.
что единственная сохраняющаяся при движении системы величина, от к-рой
зависит w,- это энергия системы. Разумеется, сохраняются также импульс
и момент импульса, но эти величины можно исключить, предположив, что рассматриваемое
тело заключено в неподвижный ящик, к-рому частицы могут отдавать импульс
и момент.
системы, а макроскопич. тела, являющиеся макроскопически малыми частями,
или подсистемами, к.-л. замкнутой системы. Функция распределения для подсистемы
будет отлична от (5), но не будет зависеть от конкретного характера остальной
части системы - т. н. термостата. Поэтому функцию распределения подсистемы
можно определить, считая, напр., что термостат состоит просто из N частиц
идеального газа, координаты и импульсы к-рых будем обозначать через Q и
P,
в отличие от обозначений q и р для подсистемы, тогда микроканонич.
распределение:
![]()
подсистемы, M - масса частицы газа, а суммирование производится
по всем составляющим импульсов всех частиц термостата. Чтобы найти функцию
распределения для подсистемы, нужно проинтегрировать это выражение по координатам
и импульсам частиц термостата. Если затем учесть, что число частиц в термостате
много больше, чем в подсистеме, и устремить N -> беск. , считая,
что отношение E/N постоянно и равно 3/2 kГ, то
для функции распределения подсистемы получится выражение:
смысл темп-ры, k = 1,38 ·1016 эрг/град - постоянная
Больцмана. [Условие E/F -> 3/2 kT
для газа в термостате
соответствует, как и должно быть, формуле (13) для идеального газа; см.
ниже.] Нормировочный коэффициент eF/KTопределяется из
условия нормировки (4):
![]()
Гиббса, или просто каноническим распределением (см Гиббса распределение),
а
величина Z - статистич. интегралом. В отличие от микроканонич. распределения,
энергия системы в распределении Гиббса не задана. Состояния системы сосредоточены
в тонком, но конечной толщины слое вокруг энергетич. поверхности, соответствующей
ср. значению энергии, что означает возможность обмена энергией с термостатом.
В остальном в применении к определённому макроскопич. телу оба распределения
приводят по существу к одним и тем же результатам. Разница лишь в том,
что при использовании микроканонич. распределения все ср. значения оказываются
выраженными через энергию тела, а при использовании канонич. распределения
- через темп-ру.
частей 1 н 2 с функциями Гамильтона H
H
для всего тела H = H
функция распределения тела разбивается на произведение функций распределения
для каждой из частей, так что эти части оказываются статистически независимыми.
Это требование вместе с теоремой Лиувилля можно положить в основу вывода
распределения Гиббса, не обращаясь к микроканонич. распределению.
описываются классич. механикой.
системы конечного объёма дискретен. Вероятность подсистеме находиться в
состоянии с энергией E
(6):
![]()
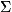
1 можно переписать в виде:
![]()
сумма в выражении (8) берётся по всем состояниям системы. Для системы,
с достаточной точностью описывающейся классич. механикой, в формуле (8)
можно перейти от суммирования по состояниям к интегрированию по координатам
и импульсам системы. При этом на каждое квантовое состояние приходится
в фазовом пространстве "клетка" (или "ячейка") объемом (2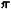 h)3N,
h)3N,
где h -Планка постоянная. Иными словами, суммирование по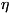 сводится
сводится
к интегрированию по dpdq/(2 h)3N.
h)3N.
Следует
также учесть, что ввиду тождественности частиц в квантовой механике при
их перестановке состояние системы не меняется. Поэтому, если интегрировать
по всем и q, необходимо
и q, необходимо
поделить интеграл на число перестановок из N
частиц, т. е. на N
Окончательно классич. предел для статистич. суммы имеет вид:
условия нормировки (6а), что приводит к дополнит, слагаемому в F.
когда число частиц в подсистеме задано. Если выбрать в качестве подсистемы
определённый элемент объёма всей системы, через поверхность к-рого частицы
могут покидать подсистему и возвращаться в неё, то вероятность нахождения
подсистемы в состоянии с энергией E
N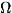 -En-
-En-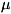 Nn)/kT,
Nn)/kT,
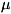
- химический потенциал, определяющий ср. число частиц в подсистеме,
а величина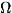 определяется
определяется
из условия нормировки [см. формулу (11)].
Важнейший результат С. ф.- установление статистич. смысла термодинамич.
величин. Это даёт возможность вывести законы термодинамики из осн. представлений
С. ф. и вычислять термодинамич. величины для конкретных систем. Прежде
всего термодинамич. внутренняя энергия отождествляется со ср. энергией
системы. Первое начало термодинамики получает тогда очевидное истолкование
как выражение закона сохранения энергии при движении составляющих тело
частиц.
зависит от нек-рого параметра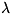
(координаты стенки сосуда, в к-рый заключена система, внешнего поля и т.
п.). Тогда производная дН/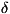
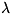 будет
будет
обобщённой
силой, соответствующей этому параметру, а величина
(dH/d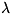 )d
)d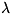 после
после
усреднения даёт механич. работу, совершаемую над системой при изменении
этого параметра. Если продифференцировать
для
ср. энергии E системы с учётом формулы (6) и условия нормировки,
считая переменными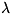
и Г и учитывая, что величина F тоже является функцией от этих переменных,
то получится тождество:
![]()
d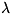 ,
,
равен
ср. работе dA, совершаемой над телом. Тогда последний член есть
получаемое телом тепло. Сравнивая это выражение с соотношением представляющим
собой объединённую запись первого и второго начал термодинамики (см. Второе
начало термодинамики)
для
обратимых процессов, находим, что
T
в (6) действительно равна абс. темп-ре тела, а пролзводная dF/дТ
- взятой с обратным знаком
энтропии S. Это означает, что F
есть
свободная энергия
тела, откуда выясняется её статистич. смысл.
энтропии, к-рое следует из формулы (8). Формально суммирование в этой формуле
производится по всем состояниям с энергией E
ввиду малости флуктуации энергии в распределении Гиббса существенно лишь
относительно небольшое их число с энергией вблизи ср. энергии. Число этих
существенных состояний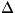 n
n
естественно определить поэтому, ограничив суммирование в (8) интервалом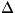 n,
n,
заменив E
из-под знака суммы. Тогда сумма даст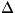 n
n
и
(8) примет вид:
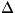 n
n
F=E
- TS, что даёт связь энтропии с числом микроскопич. состояний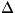 n
n
в данном макроскопич. состоянии, иначе говоря, - со статистическим весом
макроскопич.
состояния, т. е. с его вероятностью:
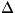 n.
n.
(10) При темп-ре абс. нуля любая система находится в определённому с н
о в н о м состоянии, так что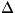 n
n
= 1, S=O. Это утверждение выражает собой третье начало термодинамики.
Здесь
существенно, что для однозначного определения энтропии нужно пользоваться
именно квантовой формулой (8); в чисто классич. статистике энтропия определена
только с точностью до произвольного слагаемого. Смысл энтропии как меры
вероятности состояния сохраняется и по отношению к произвольным - не обязательно
равновесным - состояниям. В состоянии равновесия энтропия имеет максимальное
возможное в данных внешних условиях значение. Это означает, что равновесное
состояние является состоянием с максимальным статистич. весом, наиболее
вероятным состоянием. Процесс перехода системы из неравновесного состояния
в равновесное есть процесс перехода из менее вероятных состояний в более
вероятные; это выясняет статистич. смысл закона возрастания энтропии, согласно
к-рому энтропия замкнутой системы может только увеличиваться.
F со статистич. суммой, является основой для вычисления термодинамич. величин
методами С. ф. Она используется, в частности, для построения статистич.
теории электрич. и магнитных свойств вещества. Напр., для вычисления магнитного
момента тела в магнитном поле следует вычислить статистич. сумму и свободную
энергию. Магнитный момент т тела даётся тогда формулой:
![]()
поля.
канонич. распределении (9) определяет термодинамический потенциал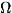 ,
,
согласно формуле:
![]()
соотношением: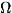 =
=
F-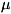 N
N
свойств конкретных систем сводятся по существу к приближённому вычислению
статистич. суммы с учётом специфич. свойств системы.
применением закона равнораспределения по степеням свободы, утверждающего,
что теплоёмкость C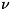 )
)
системы взаимодействующих материальных точек - частиц, совершающих
гармоннч. колебания, равна c
вращат. степеней свободы, n - число колебат. степеней свободы. Доказательство
закона основано на том, что функция Гамильтона
H
такой системы имеет
вид: H = = K(p
энергия К - однородная квадратичная функция от
l + n импульсов
p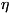
колебат. координат q
интегрирование по колебат. координатам ввиду быстрой сходимости интеграла
можно распространить от -бескон. до бескон.. Сделав после этого
корень Tp
что Z зависит от темп-ры как Тl/2+n, так что свободная
энергия F= - kT (1/2 + п) (InT+ const). Отсюда следует приведённое
выше выражение для теплоёмкости, поскольку Cv = - Td2F/dT2.
Отклонения
от закона равнораспределения в реальных системах связаны прежде всего с
квантовыми поправками, т. к. в квантовой С. ф. этот закон несправедлив.
Существуют также поправки, связанные с негармоничностью колебаний.
С. ф. является идеальный газ, т. е. газ настолько разреженный, что можно
пренебречь взаимодействием между его молекулами. Термодинамич. функции
такого газа можно вычислить до конца. Энергия газа равна просто сумме энергий
отдельных молекул. Этого, однако, ещё недостаточно, чтобы считать молекулы
полностью независимыми. Деиствительно, в квантовой механике, даже если
силы взаимодействия между частицами отсутствуют, существует определённое
влияние
одинаковых (тождественных) частиц друг на друга, если он:; находятся в
близких квантовомеханич. состояниях. Это т. н. обменное взаимодействие.
Им
можно пренебречь, если на одно состояние приходится в среднем много меньше
одной частицы, что во всяком случае имеет место при достаточно высокой
темп-ре газа; такой газ наз. невырожденным. Фактически обычные газы, состоящие
из атомов и молекул, невырождены при всех темп-pax (при к-рых они ещё газообразны).
Для невырожденного идеального газа функция распределения распадается на
произведение функций распределения для отдельных молекул. Энергия молекулы
одноатомного газа во внешнем поле с потенциальной энергией U(r) равна
р2/2М
+ + U(r). Интегрируя (6) по координатам r(х, у, г) и импульсам
P(рх,
рy, pz) всех молекул, кроме одной, можно найти число молекул
dN,
импульсы к-рых лежат в интервалах dp![]()
- Больцмана (см. Болъцмана статистика). Если проинтегрировать (12)
по импульсам, то получится формула для распределения частиц по координатам
во внешнем поле, в частности в поле тяготения - барометрическая формула.
Распределение
же по скоростям в каждой точке пространства совпадает с Максвелла распределением.
распадается на произведение одинаковых членов, соответствующих отдельным
молекулам. Для одноатомного газа суммирование в (8) сводится к интегрированию
по координатам и импульсам, т. е. сумма заменяется на интеграл по d3pd3x/(2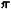 h)3в
h)3в
соответствии с числом ячеек [с объёмом (2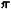 h)3]
h)3]
в фазовом пространстве одной частицы. Свободная энергия N атомов
газа равна:
![]()
атома, т. е. число состояний, соответствующее его нижнему энергетич. уровню,
V - объём газа (здесь е - основание натуральных логарифмов). При
высоких темп-pax g = (2J + 1)(2L + 1), где J - величина спина,
a
L - момента орбитального атома (в единицах h). Из выражения для
свободной энергии следует, что уравнение состояния идеального газа, т.
е. зависимость его давления (P) от плотности числа частиц (N/V)
и
температуры, имеет вид: PV = NkT.
Внутр. энергия одноатомного газа
и его теплоёмкость при постоянном объёме оказываются равными:
![]()
![]()
(т. е. с достаточной точностью подчиняющегося классич. механике) газа
потенциала содержат постоянную Планка h. Это, в конечном счёте,
обусловлено отмеченной ранее связью энтропии с понятием числа квантовых
состояний.
вклад в термодинамич. функции вносят также колебания и вращение молекул.
Этот вклад зависит от того, существенны ли эффекты квантования колебаний
и вращения молекулы. Расстояние между колебат. уровнями энергии имеет порядок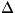 Еk
Еk
= h?, где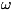
- характерная частота колебаний, а расстояние между первыми вращат. уровнями
энергии порядка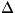 Е
Е
случае молекулы. Классич. статистика справедлива, если темп-pa достаточно
высока, так что
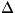 E.
E.
равнораспределения вращение вносит в теплоёмкость постоянный вклад, равный
1/2k на каждую вращат. степень свободы; в частности, для двухатомных
молекул этот вклад равен k. Колебания же вносят в теплоёмкость вклад,
равный k на каждую колебат. степень свободы (так что колебат. теплоёмкость
двухатомной молекулы равна k). Вдвое больший вклад колебательной
степени свободы по сравнению с вращательной связан с тем, что при колебаниях
атомы в молекуле имеют не только кинетическую, но и потенциальную энергию.
В обратном предельном случае kТ<h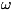
молекулы находятся в своём осн. колебательном состоянии, энергия к-рого
не зависит от температуры, так что колебания вообще не вносят вклада в
теплоёмкость. То же относится к вращению молекул при условии kT <h2/21.
По
мере повышения темп-ры появляются молекулы, находящиеся в возбуждённых
колебат. и вращат. состояниях, и эти степени свободы начинают давать вклад
в теплоёмкость - как бы постепенно "включаются", стремясь при дальнейшем
повышении темп-ры к своему классич. пределу. T. о., учёт квантовых эффектов
позволил объяснить экспериментально наблюдаемую зависимость теплоёмкости
газов от темп-ры. Значения величины h2/2kl, характеризующей
"вращательный квант", для большинства молекул порядка неск. градусов или
десятков градусов (85 К для H
классических значений теплоёмкости) от температуры
T.
величины h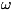 /k
/k
для
"колебат. кванта" порядка тысяч градусов (6100 К для H
температурная зависимость вращательной (а) и колебательной (б) теплоёмкостей
для двухатомной молекулы (вращат. теплоёмкость построена для молекулы из
разных атомов).
Неидеальный газ. Важное достижение
С. ф. - вычисление поправок к термодинамическим величинам газа, связанных
с взаимодействием между его частицами. С этой точки зрения уравнение состояния
идеального газа является первым членом разложения давления реального газа
по степеням плотности числа частиц, поскольку всякий газ при достаточно
малой плотности ведёт себя как идеальный. С повышением плотности начинают
играть роль поправки к уравнению состояния, связанные с взаимодействием.
Они приводят к появлению в выражении для давления членов с более высокими
степенями плотности числа частиц, так что давление изображается т. н. вириальным
рядом вида:
![]()
и наз. вторым, третьим и т. д. вириальными коэффициентами. Методы С. ф.
позволяют вычислить эти коэффициенты, если известен закон взаимодействия
между молекулами газа. При этом коэффициенты В, С,...
описывают
одновременное взаимодействие двух, трёх и большего числа молекул. Напр.,
если газ одноатомный и потенциальная энергия взаимодействия его атомов
U(r), то второй вириальный коэффициент равен
![]()
равен r
r
по степеням безразмерного параметра
Nr3/V,
малого для
достаточно разреженного газа. Взаимодействие между атомами газа носит характер
отталкивания на близких расстояниях и притяжения па далёких. Это приводит
к тому, что В > О при высоких темп-pax и В<0
при низких.
Поэтому давление реального газа при высоких темп-pax больше давления идеального
газа той же плотности, а при низких- меньше. Так, напр., для гелия при
T = 15,3 К коэффициент
В = = - 3*10-23см3,
а
при T = 510 К В = 1,8 *10"23 ел3. Для
аргона B = = -7,1 *10-23 см3при
T
= 180 К и В = 4,2 *10-23см3 при T
=
6000 К. Для одноатомных газов вычислены значения вириальных коэффициентов,
включая пятый, что позволяет описывать поведение газов в достаточно широком
интервале плотностей (см. также Газы).
Плазма. Особый случай неидеального
газа представляет собой плазма - частично или полностью ионизованный
газ, в к-ром поэтому имеются свободные электроны и ионы. При достаточно
малой плотности свойства плазмы близки к свойствам идеального газа. При
вычислении же
что электроны и ионы взаимодействуют электростатически по закону Кулона.
Кулоновские силы медленно убывают с расстоянием, и это приводит к тому,
что уже для вычисления первой поправки к термодинамич. функциям необходимо
учитывать взаимодействие не двух, а сразу большого количества частиц, поскольку
интеграл во втором вириальном коэффициенте (16), описывающий парное взаимодействие,
расходится на больших расстояниях г между частицами. В действительности
под влиянием кулоновских сил распределение ионов и электронов в плазме
изменяется таким образом, что поле каждой частицы экранируется, т. е. быстро
убывает на нек-ром расстоянии, наз. дебаевским радиусом. Для простейшего
случая плазмы, состоящей из электронов и однозарядных ионов, дебаевский
радиус T![]()
е -
заряд
электрона. Все частицы, находящиеся внутри дебаевского радиуса, принимают
участие во взаимодействии одновременно. Это приводит к тому, что первая
поправка к давлению пропорциональна не (N/V)2, как в
обычном газе, а более низкой степени плотности - (N/V)3/2. Количественный
расчёт основан на том, что остальные частицы распределены в поле выбранного
электрона или иона согласно распределению Больцмана. В результате уравнение
состояния с учётом первой поправки имеет вид:
![]()
полное число частиц равно 2N). Такого же рода поправки возникают и в термодинамич.
функциях электролитов, в к-рых имеются свободные ионы растворённых веществ.
Жидкости. В отличие от газа, связанные
с взаимодействием члены в уравнении состояния жидкости не малы. Поэтому
свойства жидкости сильно зависят от конкретного характера взаимодействия
между её молекулами. В теории жидкости вообще отсутствует малый параметр,
к-рый можно было бы использовать для упрощения теории. Невозможно получить
к.-л. аналитич. формулы для термодинамич. величин жидкости. Одним из способов
преодоления этой трудности является изучение системы, состоящей из сравнительно
небольшого числа частиц - порядка неск. тысяч. В этом случае, используя
ЭВМ, можно провести прямое решение уравнений движения частиц и определить
таким способом ср. значения всех характеризующих систему величин без дополнит,
предположений. При этом можно исследовать также и процесс приближения такой
системы к состоянию равновесия. Можно также найти статистич. интеграл для
такой системы из небольшого числа частиц путём вычисления на ЭВМ интегралов
в осн. формуле для статистич. интеграла (обычно при этом используется Монте-Карло
метод). Полученные обоими способами результаты имеют, однако, малую
точность в приложении к реальным жидкостям из-за малого числа частиц в
системе.
основан на использовании функций распределения молекул. Если проинтегрировать
функцию распределения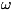 системы
системы
по импульсам всех частиц и по координатам всех частиц, кроме одной, получится
одночастичная пространств, функция распределения f
проинтегрировать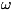 по
по
импульсам всех частиц и по координатам всех частиц, кроме двух, получится
двухчастичная функция распределения f
является непосредственно наблюдаемой физ. величиной - через неё выражается,
напр., упругое рассеяние рентгеновских лучей и нейтронов в жидкости. Считая,
что функция распределения всей системы даётся распределением Гиббса (6),
можно получить интегральное соотношение, выражающее двухчастичную функцию
через трёхчастичную и потенциал взаимодействия между частицами. В теории
жидкости это точное соотношение дополняется нек-рыми приближёнными, выражающими
трёхчастичную функцию через двухчастичную (одночастичная функция в однородной
жидкости сводится к постоянной). В результате получается уравнение для
двухчастичной функции, к-рое решается численно. Дополнит, соотношения находятся
на основании правдоподобных физ. соображений и носят интерполяционный характер,
так что основанные на них теории могут претендовать лишь на качеств, описание
свойств жидкости. Тем не менее даже такое качеств, описание имеет важное
значение, поскольку в нём проявляется общность законов С. ф. (см. также
Жидкость).
Химическое равновесие.
Большое значение
имеет предоставляемая С. ф. возможность вычисления констант хим. равновесия,
определяющих равновесные концентрации реагирующих веществ. Термодинамич.
теория приводит к условию равновесия в виде равенства нулю нек-рой линейной
комбинации хим. потенциалов этих веществ. В случае реакции между газами
хим. потенциалы определяются формулами, аналогичными формуле (14) для одноатомного
газа, и константу равновесия можно вычислить, если известна теплота реакции.
В выражения для хим. потенциалов входит постоянная Планка, поэтому квантовые
эффекты существенны даже для реакций между классич. газами. Важным частным
случаем формул хим. равновесия является
Саха формула, определяющая
равновесную степень ионизации газа. (Подробнее см. Равновесие химическое.)