СТАНДАРТНЫЕ СОСТОЯНИЯ
условно принятые
термодинамич. состояния индивидуальных веществ н компонентов растворов.
Представление о С. с. введено в связи с тем, что простые термодпнамич.
закономерности не описывают достаточно точно поведение реальных веществ,
когда количеств, характеристикой служит давление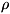 или
или
концентрация с. Термодинамнч. ур-ния для идеальных газов и
растворов
можно
применять к реальным системам, если вместо давления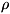 использовать
использовать
фугитивность
f, а вместо концентрации с -
активность а.
Отсчёт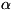
и f принято начинать для всех веществ в их С. с.
С. с. газа при каждой темп-ре - это гипотетич.
Представления о С. с. широко используются
Лит.: КарапетьянцМ. X., Химическая
M. X. Карапетъянц.
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
состояние идеального газа, когда f =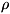 =
=
1 н газ обладает свойствами, присущими реальному газу при бесконечно малом
давлении. Для жидких и крнсталлич. индивидуальных веществ в качестве С.
с. при каждой темп-ре принимается их состояние под нормальным давлением.
В случае растворов за С. с. для растворителя обычно принимают состояние
чистого растворителя, а для растворённого вещества - его состояние в бесконечно
разбавленном растворе, когда для него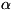
= с (обычно с - мольная доля или молярность; см. Концентрация).
Изменения
термодинамич. параметров - гиббсовой энергии, энтропии и др. - для
к.-л. процесса, вычисляемые с помощью f или а, не зависят
от выбора С. с. при условии, что в данном расчёте оно неизменно для всех
начальных и конечных состояний. К символам, обозначающим свойства вещества
(характеристики процесса) в С. с., добавляется знак градуса как верхний
индекс (напр.,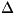 Н
Н
в физ. химии. При сравнении термодинамич. функций (см. Термодинамика
химическая) и проведении термохимич. расчётов (напр., на основе Гесса
закона) необходимо, чтобы все тепловые эффекты реакций были отнесены
к одинаковым условиям, т. к. они зависят от темп-ры (в меньшей степени
от давления), а для реакций в растворах - от концентрации. В термохимии
в
качестве С. с. принимают состояние веществ, в котором они находятся при
298,15 К и р = 1 атм (760 мм рт. ст.). Следует отметить,
что возможность существования вещества в С. с. не обязательна; так, в расчётах
может фигурировать теплота образования газообразной H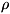
= 1 атм и 25 0C термодинамически невозможно.
термодинамика, Зизд., M., 1975.