СОПРЯЖЕНИЕ СВЯЗЕЙ
один из важнейших
видов внутримолекулярного взаимного влияния атомов и связей в органич.
соединениях; обусловлено взаимодействием электронных систем атомов (прежде
всего валентных электронов, см. Валентность). Главный признак сопряжения
- распределение по всей сопряжённой системе электронной плотности, создаваемой
р-
и
п-электронами. Такими системами являются: чередующиеся простая и кратные
связи - двойные или тройные; см. Простая связь, Кратные связи
(п,
п-сопряжение, как, напр., в бутадиене, I; здесь и далее жирными штрихами,
а также точками выделена сопряжённая система); кратная связь и атом со
свободной электронной парой (р,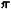 -сопряжение,
-сопряжение,
напр, в винилхлориде, II); кратная связь и способная к сопряжению простая
связь (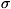 , я-сопряжение,
, я-сопряжение,
например в хлормеркурацетальдегиде, III); две способные к сопряжению простые
связи (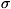 ,
,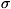 -сопряжение,
-сопряжение,
например в этанолмеркурвлориде, IV). Такая классификация сопряжённых систем
предложена в начале 50 х гг. 20 в. A. H. Несмеяновым.
CH I
CH II
ClHg-CH III
ClHg-CH IV
Общая особенность всех сопряжённых систем
Количество образующихся продуктов 1,2-и
Истинное распределение электронной плотности
Для проявления С. с. необходимо, чтобы
бензольные ядра не могут разместиться в
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
- "растекание" электронной плотности р- и -электронов
-электронов
(см. Сигма- и пи-связи) по всей сопряжённой системе - определяет
их физ. и хим. свойства. Так, простые связи приобретают нек-рую чдвоесвязность",
выражающуюся, в частности, в уменьшении их длины. Напр., в бутадиене длина
центральной С - С-связи 1,46 А вместо обычной 1,54 А. С. с. проявляется
также, напр., в УФ- и ИК-спектрах, дипольных моментах. Наиболее характерная
хим. особенность сопряжённых систем - способность вступать в реакции не
только с участием одной кратной связи, но и всей сопряжённой системы как
единого целого. Примером может служить, напр., присоединение к бутадиену
хлористого водорода:
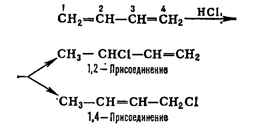
1,4-присоединения зависит от природы сопряжённой системы, от реагента и
условий реакции. Сопряжение снижает внутр. энергию молекул и, следовательно,
делает их более устойчивыми: величина энергии сопряжения колеблется между
неск. единицами и десятками ккал/моль (напр., для бутадиена 3,6
ккал/моль,
для
бензола 35 ккал/моль; 1 ккал/моль = = 4,19 кож/моль).
в сопряжённых системах нельзя выразить простейшими структурными формулами.
Их строение более точно передаётся наборами предельных структур (см. Мезомерия,
Резонанса теория), формулами с пунктирными ("полуторными") связями
или с изогнутыми стрелками, указывающими направление сдвига электронов,
напр.:
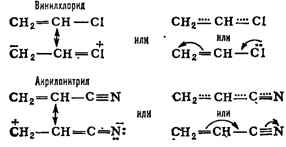
участвующие в нём электронные системы находились в одной плоскости. Если
структура молекулы не допускает этого, то говорят о пространственных препятствиях
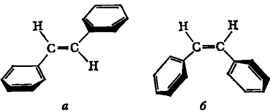
сопряжению. Так, у транс-стильбена (а), по данным УФ-спектров,
обнаруживается более сильное сопряжение, чем у цис-стильбена
(6),
у
к-рого
одной плоскости с двойной связью: