СЛОЖНЫЕ РЕАКЦИИ
такие
Под чертой приведено итоговое
Наиболее важные типы С. р.-
Если С. р. происходит в открытой
Важнейшим случаем нестационарных
Лит.: Эмануэль Н.
М. И. Тёмкин.
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
реакции
химические, элементарные акты к-рых различны. В противоположность С.
р. элементарные акты простых реакций не отличаются один от другого природой
участвующих в них веществ, а лишь, возможно,- направлением превращения,
если реакция обратима (в последнем случае нек-рые авторы реакцию также
называют сложной). С. р. можно рассматривать как совокупность простых реакций,
к-рые в этом случае наз. стадиями сложной реакции. Иногда все образующиеся
в ходе С. р. вещества являются её продуктами в том смысле, что они могут
быть получены в количествах, сравнимых с затраченными количествами исходных
веществ. Таковы, в частности, последовательные реакции и параллельные
реакции. Более распространён, однако, тип химических реакций, иллюстрируемый
примером гомогенного распада закиси азота N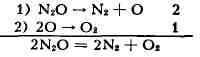
ур-ние реакции, выражающее её конечный результат, устанавливаемый с помощью
хим. анализа или каким-либо иным сравнительно грубым методом, напр. по
изменению давления, если реакцию проводят в замкнутой системе. Чтобы получить
итоговое ур-ние суммированием хим. уравнений стадий 1 и 2, эти ур-ния надо
предварительно умножить на числа, написанные справа от них. Такие числа
наз. стехиометрическими числами. Вещества, образующиеся и расходующиеся
на разных стадиях, но не входящие в итоговые ур-ния, наз. промежуточными
веществами (атомный кислород, напр.,- промежуточное вещество распада N
каталитические реакции (см. Катализ) и цепные реакции. Особенность
тех и других - циклическое образование и расходование промежуточных веществ;
осн. различие состоит в характере этих промежуточных веществ. При катализе
промежуточные вещества - устойчивые образования, способные сами по себе,
в отсутствие реакции, существовать неопределённо долго. Промежуточные вещества
цепных реакций - атомы, свободные радикалы или возбуждённые молекулы -
могут существовать только короткое время.
системе, при непрерывной подаче с постоянной скоростью исходных веществ
и с непрерывным удалением продуктов реакции, то реакция может происходить
стационарно. Каждое промежуточное вещество тогда образуется и расходуется
с одинаковой скоростью, так что его кол-во в системе не изменяется со временем.
Реакция в замкнутой системе может происходить квазистационарно, если среднее
время жизни промежуточных веществ мало по сравнению со временем, за к-рое
происходит существенное изменение состава реагирующей смеси. При этом течение
реакции в каждый момент практически не отличается от стационарного.
реакций являются реакции с разветвляющимися цепями, теория к-рых была создана
Н. Н. Семёновым. Скорость отдельных стадий С. р. определяется действующих
масс законом, на основе к-рого можно получить ур-ния, описывающие течение
С. р. Задача значительно упрощается, если реакция стационарна или квазистационарна.
М., К н о р р е Д. Г., Курс химической кинетики, 3 изд., М., 1974; Механизм
и кинетика сложных каталитических реакций, М., 1970.