ПРОСТАЯ СВЯЗЬ
ординарная связь,
(где X = В-, С и N+
Е. М. Шусторович.
одинарная связь, химическая ковалентная связь, осуществляемая парой электронов
(с антипараллельной ориентацией спинов), движущихся в поле 2 атомных ядер.
Напр., в молекулах Н
(находившихся на атомных орбиталях 1s - 1s, 3р - 3р и 1s - 3р
соответственно).
Поскольку эти молекулы двухатомны, хим. связи в них двухцентровые. Для
указанных молекул можно написать след. электронные и структурные формулы:
Н:Н и Н-Н, Сl:Сl и Сl-Сl, Н:Сl и Н-Сl [две точки и валентный штрих (чёрточка)
обозначают пару электронов, общую для обоих соединившихся атомов]. Аналогичное
описание справедливо для молекул всех насыщенных соединений, у к-рых число
пар валентных электронов равно числу возможных двухцентровых взаимодействий.
В таких соединениях все хим. связи являются П. с. (с кратностью, равной
единице). Пара электронов П. с. в равной степени может иметь и донорно-акцепторное
происхождение (см. Донорно-акцепторная связь). Поэтому, напр., изоэлектронные
молекула CH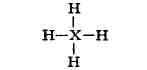
соответственно). В хим. соединениях, в к-рых среднее число электронов,
связывающих каждую пару атомных ядер, не равно двум, могут возникнуть хим.
связи самой различной кратности - как меньше единицы (соединения с дефицитом
электронов), так и больше единицы (соединения с кратными связями). В
этих случаях описание электронного строения молекул обычно требует привлечения
наиболее общего метода квантовой химии - молекулярных орбиталей метода.
А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Ъ Ы Ь Э Ю Я