ПЕРЕКИСЬ ВОДОРОДА
, пероксид водорода,
Очень чистая П. в. достаточно устойчива,
Как восстановитель - переводит Mn(VII)
Эти реакции используются для количеств.
Механизм окисления различных веществ П,
Смесь растворов Н В лаборатории П. в. получают, действуя
а также самоокислением производных антрахинонового
В природе П. в. образуется как промежуточный
Высококонцентрированная П. в., разлагающаяся
В связи с проблемами загрязнения окружающей
В медицине П. в.- препарат из группы антисептических
Лит.: Шамб У., Сеттерфильд Ч., Вентворс
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
Н
в любых отношениях, образует кристаллогидрат n
Открыта
в 1818 Л. Ж. Тенаром.
но в присутствии тяжёлых металлов и их ионов разлагается на Н
П. в.- экзотермич. процесс и может проходить со взрывом. В разных условиях
П. в. может играть роль как окислителя (что более характерно), так и восстановителя.
Как окислитель П. в. выделяет, напр., иод из иодидов:
![]()
в Мn(II):
![]()
определения П. в. в растворе.
в. сложен; в реакциях в качестве промежуточных веществ образуются активные
частицы (НО
2-валентного железа в растворе:
![]()
различных органич. веществ.
на холоду разбавленными к-тами на перекиси металлов-ВаО
к-ты H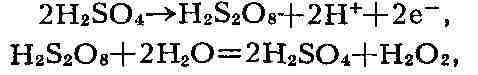
ряда и окислением изопропилового спирта.
или побочный продукт при окислении мн. веществ кислородом воздуха; следы
её содержатся в атм. осадках. П. в. образуется в растительных и животных
клетках, но концентрация её очень мала, т. к. под действием ферментов каталазы
и пероксидазы протекают быстрые реакции разложения П. в. и окисления ею
органич. веществ.
на окисном катализаторе, даёт нагретую до высоких темп-р (700 оС)
водно-кислородную газовую смесь ("парогаз") - топливо в реактивных двигателях.
В хим. пром-сти П. в. применяется как окислитель, как сырьё для получения
мн. перекисных соединений, как инициатор полимеризации; для отбеливания
шёлка, шерсти, пера, мехов.
среды отходами хим. произ-в П. в. приобретает особое значение как "чистый"
окислитель, не образующий токсич. продуктов. Произ-во высококонцентриррванной
П. в. (90-98% ) неуклонно растёт. Для её хранения используют ёмкости из
алюминия, а в качестве стабилизаторов обычно пирофосфат натрия Na
слизистую оболочку и в дыхательные пути вызывают ожоги.
средств, оказывающий дезинфицирующее и дезодорирующее действие. 3%
-ный раствор П. в. применяют для промываний и полосканий при стоматите,
ангине, гинекологич. заболеваниях, иногда- для остановки носовых кровотечений.
Когда требуются растворы более высоких концентраций, для их изготовления
используют пергидроль. Растворы и мази, содержащие П. в., применяют
также в качестве депигментирующих средств.
Р., Перекись водорода, пер. с англ., М., 1958. А. П. Пурмалъ.