ПАССИВИРОВАНИЕ
пассивация металлов,
переход поверхности металла в пассивное состояние, при к-ром резко замедляется
коррозия.
П.
вызывается поверхностным окислением металлов. Практич. значение П. исключительно
велико, так как все конструкционные металлы без их самопроизвольного П.
подвергались бы быстрой коррозии не только в агрессивных хим. средах, но
и во влажной земной атмосфере или пресной воде.
Если погрузить металл, склонный к П., в
Все перечисленные величины являются важными
Для того чтобы П. было самопроизвольным
Перепассивация вызывается образованием
либо отдают в раствор свои катионы, распадаясь
В технике термин "П." означает также спец.
Лит.: Томашов Н. Д., Чернова Г.
В. М. Новаковский.
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
неокислительный водный раствор электролита, подключить его к источнику
тока, позволяющему задавать любые значения потенциала (т. н. потенциостату)
и записать зависимость плотности тока растворения металла от задаваемого
потенциала, то получится поляризационная кривая, близкая к представленной
на рисунке. Кривая показывает, что П. металла начинается при потенциале
пассивации En и критической плотности тока i
П. иногда в 104-105 раз (до i
Е
затем новое ускорение растворения связывают с перепассивацией, или транспассивным
состоянием. Интервал от Е
областью пассивного состояния. В присутствии ионов С1-, Вr <-,
I<- местное сильное растворение ("питтинг") нек-рых пассивных
металлов начинается ещё при потенциале
![]()
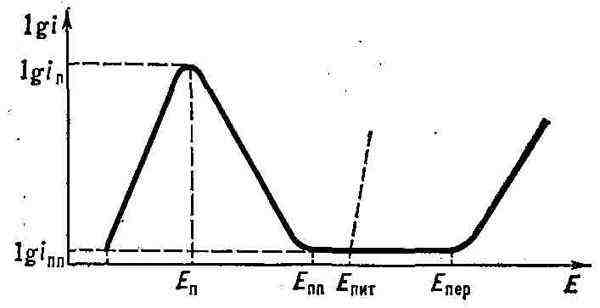
характеристиками поведения металлов и при коррозии под действием окислителей.
Так, металл корродирует с минимальной скоростью (эквивалентной плотности
тока в полностью пассивном состоянии i
потенциал ![]()
![]()
(при отсутствии внеш. источников тока), скорость восстановления окислителя
при Е
а в отношении железа -только первому. Соответственно Сr в них пассивируется
сам, a Fe только может сохранять пассивное состояние, созданное каким-то
способом ранее. Поскольку для Сr i
- на 0,4-0,5 в отрицательнее, Сr несравненно устойчивее Fe в слабо
окислительных средах, но вследствие перепассивации значительно сильнее
разрушается в сильных окислителях (дымящей азотной к-те, к-тах с добавками
перманганатов, хроматов и др.). Сильное повышение концентрации к-ты или
щёлочи обычно ведёт к увеличению i
Сr, Ni и богатые ими сплавы, Ti, Zr. В нейтральных средах к П. в той или
иной мере склонна большая часть металлов. В неводных растворах П. часто
оказывается возможным только в присутствии влаги. В теории П. важная роль
отводится как адсорбции кислорода, так и образованию окисных слоев.
высших кислородных соединений металла, к-рые либо растворяются целиком,
давая анионы
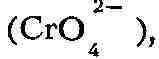
с выделением кислорода (NiО
кислорода является химически или электрохимически взаимодействующая с металлом
вода.
хим. или электрохим. обработку металла в подходящем растворителе, повышающую
стойкость его исходного пассивного состояния (П. алюминиевой посуды в 30%-ной
НNОз, цинковых покрытий в хроматных растворах и т. д.). Вещества, гл. обр.
окислители, с помощью к-рых производится П., наз. пассиваторами.
П., Пассивность и защита металлов от коррозии, М., 1965; Скорчеллетти В.
В., Теоретические основы коррозии металлов, Л., 1973; Новаковский В. М.,
Обоснование и начальные элементы электрохимической теории растворения окислов
и пассивных металлов, в сб.: Коррозия и защита от коррозии, т. 2, М., 1973.