ОРИЕНТАЦИИ ПРАВИЛА
в органической
Ещё более важно влияние ориентанта на распределение
В возникающем переходном состоянии наблюдается
Более сложно поведение галогенных ориентантов,
Ориентанты II рода за счёт действия тех
В возникающем переходном состоянии отсутствует
При наличии нескольких заместителей в ароматич.
Лит.: И н г о л ь д К., Теоретические
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
химии определяют порядок замещения в ароматич. кольце при наличии в нём
заместителя (ориентанта). При электрофильном ароматич. замещении (см. Замещения
реакции, Нуклеофилъные и электрофилъные реагенты) ориентанты I рода
(ОН, OR, OCOR, SH, SR, NH
II рода (SO
влиянием заместителя на перераспределение электронной плотности в молекуле
по системе простых (индуктивный /-эффект) и сопряжённых (мезомерный М-эффект)
связей (см. также Мезомерия). Введение ориентантов I рода увеличивает
электронную плотность бензольного кольца в целом, но особенно в орто-
и
иара-положениях, введение ориентантов II рода соответственно уменьшает.
Ниже показано смещение электронной плотности в нитробензоле (I) 'и анилине
(II); дипольные моменты этих молекул 3,95 и 1,53Д соответственно:
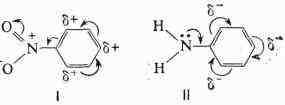
электронной плотности в переходном состоянии (см. Активированный комплекс).
Предполагается,
что структура переходного состояния близка к о-комплексу; она может быть
изображена также набором резонансных структур (см. ниже). Ориентанты I
рода за счёт индуктивного ( + I) или мезомерного ( + М)
эффектов
(знаки + и - означают соответственно электронодонорный и электроноакцепторный
характеры эффектов) облегчают электрофильное замещение, т. к. стабилизируют
переходное состояние, частично погашая возникающий положительный заряд.
Наиболее эффективно влияние ориентантов I рода за счёт сопряжения передаётся
в орто- и пара-положения бензольного кольца, поэтому в эти
положения в основном и направлена атака электрофила Е+. Примером
может служить замещение в пара-положение толуола.:
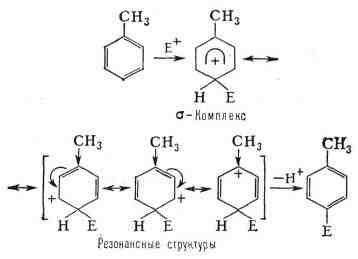
прямое взаимодействие заместителя с положительным зарядом, в результате
чего его энергия становится меньше, чем переходного состояния в случае
лета-замещения в толуоле.
у к-рых -I- и + М-эффекты действуют в противоположных направлениях. В нереагирующей
молекуле из-за -I-эффекта галоген служит отрицательным концом диполя. В
образующемся переходном состоянии при орто- и пара-замещении,
благодаря
возможности частичного погашения заряда за счёт + М-эффекта заместитель
направляется именно в эти положения. Однако электрофильное замещение происходит
труднее, чем в бензоле. Для заместителей, обладающих такой же комбинацией
эффектов, напр, для аминогруппы (NH
изменению характера ориентанта, т. к. NH
же эффектов в обратном направлении (-I- и -М-эффекты) затрудняют вступление
электрофила во все положения бензольного кольца, но особенно (за счёт эффекта
сопряжения) в орто- и пара-положения, поэтому в этом случае
замещение в основном осуществляется в мета-положение, напр, как
в нитробензоле:
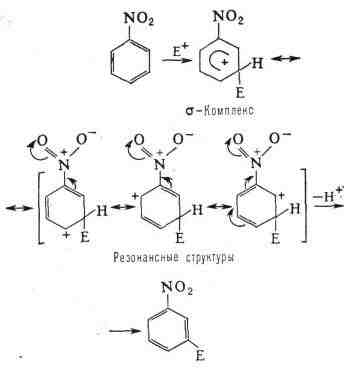
прямое взаимодействие заместителя с положительным зарядом.
кольце возможны случаи согласованной и несогласованной ориентации, как,
напр., в и- и л-нитротолуолах. Относительная реакционная способность и
эффект ориентации (избирательность реакции) в значительной степени зависят
от характера электрофиль-ного агента. Обратное влияние рассмотренных заместителей
(как на активацию замещения, так и на ориентацию) наблюдается при нуклеофильном
ароматич. замещении.
основы органической химии, пер. с англ., М., 1973. . И. П. Белецкая.