ОРГАНИЧЕСКАЯ ХИМИЯ
раздел химии,
естественнонаучная
дисциплина, предметом изучения к-рой являются соединения углерода с др.
элементами, называемые органич. соединениями, а также законы превращения
этих веществ. Углерод образует соединения с большинством элементов и обладает
наиболее выраженной способностью по сравнению с др. элементами к образованию
молекул цепного и циклич. строения. Скелет таких молекул может состоять
из практически неограниченного числа атомов углерода, непосредственно соединённых
друг с другом, или включать наряду с углеродом атомы др. элементов. Для
соединений углерода наиболее характерно явление изомерии, т. е.
существование веществ, одинаковых по составу и мол. массе, но различающихся
последовательностью сцепления атомов или расположением их в пространстве
и вследствие этого по хим. и физ. свойствам. В результате этих особенностей
число органич. веществ чрезвычайно велико, к 70-м гг. 20 в. известно более
3 млн., в то время как соединений всех остальных элементов - немногим более
100 тыс.
Органич. соединения способны к сложным
и многообразным превращениям, существенно отличным от превращений неорганич.
веществ, и играют осн. роль в построении и жизнедеятельности растительных
и животных организмов. К органич. соединениям относятся углеводы и
белки,
с
к-рыми связан обмен веществ; гормоны, регулирующие этот обмен;
нуклеиновые
кислоты, являющиеся материальными носителями наследств, признаков организма;
витамины и др. О. х. представляет собой т. о. как бы своеобразный
"мост" между науками, изучающими неживую материю и высшую форму существования
материи - жизнь. Многие явления и закономерности хим. науки, напр, изомерия,
впервые были открыты при изучении именно органич. соединений.
Классификация органических соединений.
Все
органич. соединения подразделяются на три осн. ряда, или класса: ациклические,
изоциклические и гетероциклические. К первому классу (жирных, или алифатических)
соединений относят углеводороды и их производные с незамкнутыми цепями:
гомологич. ряд метановых углеводородов, называемый также рядом
насыщенных
углеводородов, или алканов; гомологич. ряды ненасыщенных углеводородов
- этилена (алкенов), ацетилена (алкинов), диенов и др. (см. Ациклические
соединения). К классу изоциклических (карбоциклических) соединений
относят углеводороды и их произ-
водные, в молекулах которых имеются циклы
из атомов углерода: углеводороды и их производные циклопарафинового, или
полиметиленового, ряда, циклич. ненасыщенные соединения (см. Алициклические
соединения, Циклоалканы), а также ароматические углеводороды и
их производные, содержащие бензольные ядра (в частности, и многоядерные
ароматические
соединения, напр, нафталин, антрацен). К классу гетероциклических
соединений относят органич. вещества, в молекулах к-рых имеются циклы,
содержащие, кроме углерода, атомы О, N, S, Р, As или др. элементов.
От каждого углеводорода образован отд.
О названиях органич. соединений см. Номенклатура
Впервые назв. "органические соединения"
Теоретич. представления в О. х. начали
На смену теории радикалов пришла типов
В 1861 Бутлеров создал химического строения
В 1869 И. Вислиценус показал, что
К кон. 19 в. накопился большой фактич.
Электронные представления [В. Коссель
Представления Льюиса о паре электронов,
Современные представления теории строения
В представления о распределении электронной
Принято различать два вида электронного
Перераспределение электронной плотности,
Влияние сопряжения проявляется и в тех
Взаимное влияние атомов в результате сопряжения
Т. о., на основании совр. квантово-химич.
В результате развития теоретич. и физ.
Этими же обозначениями пользуются для графич.
Приблизительно со 2-й пол. 20 в. О. х.
Успехи теории и развитие физ. методов исследования
О. х. оказалась тесно связанной со смежными
Методы О. х. наряду с физ. методами исследования
Синтезирован новый класс органич. соединений,
Отд. части этих молекул связаны механич.
Большое значение приобрели методы О. х.
Научные учреждения и организации, периодические
Нац. комитет сов. химиков является членом
Периодич. издания, в к-рых публикуются
Лит.: Бутлеров А. М., Введение к
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
генетич. ряд (см. Гомологические ряды), представители к-рого формально
производятся путём замены атома водорода в углеводороде той или иной функциональной
группой, определяющей хим. свойства соединения. Так, в генегич. ряд метана
СH
гомологич. ряды производных: галоген-содержащих соединений, спиртов, аминов,
нитросоединений и др.
химическая.
Историческая справка. Истоки О.
х. восходят к глубокой древности (уже тогда знали о спиртовом и уксуснокислом
брожении, крашении индиго и ализарином). Однако ещё в средние века (период
алхимии)
были
известны лишь немногие индивидуальные органич. вещества. Все исследования
этого периода сводились гл. обр. к операциям, при помощи к-рых, как тогда
думали, одни простые вещества можно превращать в другие. Начиная с 16 в.
(период ятрохимии) исследования были направлены в основном на выделение
и использование различных лекарственных веществ: был выделен из растений
ряд эфирных масел, приготовлен простой диэтиловый эфир, сухой перегонкой
древесины получены древесный (метиловый) спирт и уксусная к-та, из винного
камня - винная к-та, перегонкой свинцового сахара - уксусная к-та, перегонкой
янтаря - янтарная. Большая роль в становлении О. х. принадлежит А. Лавуазье,
к-рый
разработал основные количеств, методы определения состава хим. соединений,
в дальнейшем последовательно улучшенные Л. Тенором, И.
Берцелиусом,
Ю. Либихом, Ж.
Дюма. Принципы этих методов (сожжение
навески вещества в атмосфере кислорода, улавливание и взвешивание продуктов
сгорания - СО
анализа, в т. ч. и микроанализа. В результате анализа большого числа
различных веществ доминировавшее ранее представление о принципиальном различии
веществ растительного и животного происхождения постепенно отпадало.
встречается к кон. 18 в. Термин "О. х." был введён Берцелиусом в 1827 (в
написанном им первом руководстве по О. х.). Явление изомерии было открыто
Ф. Вёлером и Либихом в 1822-23. Первый синтез органич. вещества
осуществил Вёлер, получивший в 1824 щавелевую к-ту из дициана и в 1828
- мочевину нагреванием циановокислого аммония. Начиная с сер. 19 в. число
органич. веществ, получаемых синтетически, быстро возрастает. Так, в 1842
Н. Н.
Зинин восстановлением нитробензола получил анилин, в 1845
А. Колъбе
синтезировал уксусную к-ту, в 1854 П. Бертло - вещества
типа жиров. В 1861 А. М. Бутлеров получил первое искусств, сахаристое
вещество, названное им метиленитаном, из которого впоследствии была выделена
акроза. Синтетическое направление в О. х. приобретает всё большее значение.
В результате успехов синтеза господствовавшее идеалистич. представление
о необходимости "жизненной силы" для создания органич. веществ (см. Витализм)
было
отвергнуто.
развиваться со 2-й четв. 19 в., когда была создана радикалов теория
(Либих,
Вёлер, Э. Франкленд, Р. Бунзен и др.). Основное её положение
о переходе группы атомов - радикалов из одного соединения в другое в неизменном
виде остаётся в большом числе случаев справедливым и в наст, время. На
этом представлении основаны многие физ. и хим. методы исследования веществ
неизвестной структуры. Впоследствии (1834-39) Дюма показал возможность
замещения положительно заряженных атомов в радикале на электроотрицательные
без серьёзных изменений электрохимического характера радикала, что до Дюма
считалось невозможным.
теория (1848-51, 1853), созданная Дюма, Ш. Жераром и О. Лораном.
Последним
удалось классифицировать органич. вещества по типам простейших неорганич.
соединений. Так, спирты считались соединениями типа воды, амины- типа аммиака,
галогеналкилы-типа хлористого водорода. Позднее Ф. А. Кекуле
установил
четвёртый тип - тип метана, от к-рого он производил все углеводороды. Теория
типов позволила создать чёткую классификацию органич. соединений, к-рая
лежит в основе совр. классификации органич. веществ. Однако эта теория
стремилась лишь к объяснению реакционной способности органич. веществ и
отрицала принципиальную возможность познания их строения. В 1853 Франкленд,
изучая металлоорганич. соединения, ввёл представление о валентности. В
1857 Кекуле высказывает мысль о возможности сцепления атомов углерода друг
с другом и доказывает четырёхвалентность углерода. В 1858 А. Купер,
используя
правило валентности и положение Кекуле о сцеплении атомов углерода, впервые
отходит от теории типов и пишет формулы органич. веществ, очень близкие
к современным. Однако идеи теории типов оставались ещё очень сильны и создание
теории продолжало отставать от развития эксперимента.
теорию органич. веществ. Он ввёл в О. х. ряд новых понятий: о химической
связи, порядке связей атомов в молекуле, о взаимном влиянии атомов, непосредственно
связанных или не связанных друг с другом, и др. Теория строения Бутлерова
блестяще объяснила остававшиеся непонятными известные к тому времени случаи
изомерии. В 1864 Бутлеров предсказал возможность изомерии углеводородов
и вскоре (1867) подтвердил это синтезом изобутана. Созданное Бутлеровым
стройное учение лежит в основе совр. представлений о хим. строении органич.
веществ. Одно из важнейших положений теории строения - о взаимном влиянии
атомов - впоследствии было развито В. В. Марковниковым. Детальное
изучение этого влияния способствовало дальнейшему развитию теории строения
и представлений о распределении электронной плотности и о реакционной способности
органич. соединений.
явление изомерии наблюдается и при совершенно одинаковой последовательности
сцепления атомов в молекуле. Он доказал идентичность строения обычной молочной
кислоты и мясо-молочной и пришёл к выводу, что тонкие различия в свойствах
молекул с одинаковой структурой следует искать в различном расположении
их атомов в пространстве. В 1874 Я. Вант-Гофф ц франц. химик
Ж. Ле Бель создали теорию пространств, расположения атомов в молекуле -
стереохимию.
В
основе этой теории, по Вант-Гоффу, лежит представление о тетраэдрич. модели
четырёхвалентного атома углерода и о том, что оптич. изомерия является
следствием пространств, асимметрии молекулы, в к-рой атом углерода соединён
с четырьмя различными заместителями (см. Асимметрический атом). Вант-Гофф
высказал также предположение о возможности др. вида пространств, изомерии
при отсутствии в молекуле асим-метрич. атома углерода. Вскоре Вислиценус
доказал, что фумаровая к-та, к-рую ранее считали полимером малеиновой к-ты,
представляет собой её геометрич. изомер (геометрическая, или цис-транс-изомерия).
Ясно, что стереохимич. учение могло быть создано только на основе представлений
о строении (структуре) молекулы в бутлеровском понимании.
материал, в т. ч. и по ароматич. соединениям; в частности, широко была
изучена химия бензола, открытого М. Фарадеем в 1825. Первая
т. н. "бензольная теория" строения ароматич. соединений была создана в
1865 Кекуле. В ней высказывается мысль о том, что атомы углерода в органич.
соединениях могут образовывать кольца. Согласно этой теории, бензол обладает
симметричной структурой вследствие кольцеобразного строения сцепленных
попеременно простыми и двойными связями шести метиновых СН-групп. Однако,
исходя из строения бензола по Кекуле, следовало допустить наличие двух
opmo-замещённых гомологов или производных бензола, чего на самом деле не
наблюдалось. УСТОЙЧИВОСТЬ бензола к сильным окислителям и нек-рые др. т.
н. ароматич. свойства бензола и его производных также противоречили предложенной
формуле. Поэтому Кекуле ввёл (1872) представление об осцилляции (быстром
перемещении) двойных связей и устранил формальные различия между двумя
opmo-положениями. Несмотря на то, что строение бензола по Кекуле находилось
в противоречии с данными о его физ. и хим. свойствах, оно долгое время
без всяких изменений принималось подавляющим числом химиков. Т. о., остался
ряд вопросов, не разрешимых с точки зрения "классической" теории строения.
К этим вопросам относится и своеобразие свойств многих др. соединений с
сопряжёнными системами связей. Строение бензола и др. ароматич. систем
могло быть установлено лишь с появлением физ. методов исследования и с
развитием квантово-хим. представлений о строении органич. веществ.
(1916)
и Г. Льюис (1916)] придали физ. содержание понятию химической
связи (пара обобщённых электронов); однако в том виде, в каком они
были сформулированы, эти представления не смогли отразить тонких переходов
от ковалентной к ионной связи и в О. х. оставались в значит, степени формальными.
Только с помощью квантово-химического учения было вложено принципиально
новое содержание в правильные в основном представления электронной теории.
образующих связь и всегда строго локализованных на этой связи, оказались
приближёнными и в большинстве случаев не могли быть приняты.
и значение О. х. Учёт квантовых свойств электрона, представления об электронной
плотности и о взаимодействии электронов в сопряжённых системах открыли
новые возможности для рассмотрения вопросов о строении, взаимном влиянии
атомов в молекуле и о реакционной способности органич. соединений (см.
Электронные
теории в органической химии, Квантовая химия). В насыщенных углеводородах
одинарные связи С-С (б-связи) действительно реализуются парой электронов;
в симметричных углеводородах электронная плотность в пространстве между
соединившимися атомами С-С больше суммы соответствующих электронных плотностей
тех же изолированных атомов и симметрично распределена относительно оси,
соединяющей центры атомов. Увеличение электронной плотности - результат
перекрывания электронных облаков атомов по прямой, соединяющей их центры.
В несимметричных парафинах появляется возможность неполной симметрии в
распределении электронной плотности; однако эта асимметрия столь незначительна,
vro дипольные моменты всех парафиновых углеводородов почти не обнаруживаются.
То же касается и симметрично построенных непредельных углеводородов (напр.,
этилена, бутадиена), у к-рых атомы С соединены друг с другом двойной связью
(а-и я-связью). Введение в молекулы этих веществ элект-ронодонорной метальной
группы вследствие высокой поляризуемости л-связи приводит к смещению электронной
плотности к крайнему атому углерода, и пропилен (I) уже имеет дипольный
момент 0,35 Д, а 1-метилбутадиен - 0,68 Д. Распределение электронной плотности
в этих случаях принято изображать одной из следующих схем:
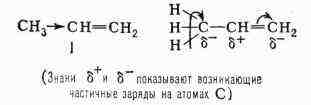
плотности хорошо укладывается ряд эмпирич. правил О. х. Так, из приведённой
выше формулы пропилена следует, что при гетеролитич. присоединении к нему
галогеноводородов протон должен фиксироваться в месте наибольшей электронной
плотности, т. е. у наиболее "гидрогенизированного" атома углерода (см.
Марковникова
правило). Значительно сильнее сказывается введение в молекулы углеводородов
атомов или групп, сильно отличающихся по электроотрицательности от атомов
углерода или водорода. Напр., введение электрофиль-ного заместителя в молекулы
углеводородов ведёт к изменению подвижности атомов водорода в связях С-Н,
О-Н и др. Подобного рода взаимное влияние атомов, также объяснимое изменением
распределения электронной плотности, быстро затухает у насыщенных соединений
и почти без затухания передаётся по цепи сопряжённых связей (см. Сопряжение
связей).
влияния заместителей: индуктивное - по цепи а-связей и влияние сопряжения
- по цепи с сопряжёнными связями. Так, увеличение кислотности хлоруксусной
к-ты (II) по сравнению с уксусной СНэСООН объясняется индуктивным влиянием
атомов хлора, а подвижность атомов водорода метальных групп в уксусном
(III) или сорбиновом (IV) альдегиде - влиянием сопряжения:
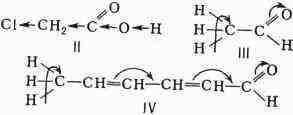
особенно в момент реакции, происходит не только в связях, к-рые затрагиваются
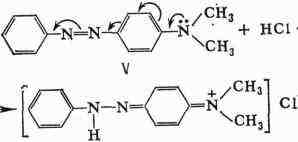
реакцией, но и в др. частях молекулы. Кажущаяся ненормальность солеобразования
к-диметиламиноазобен-зола (V) с фиксацией протона слабоосновным атомом
азота азогруппы объясняется перемещением реакционного центра молекулы вследствие
сдвига электронной плотности в момент реакции в направлении, указанном
стрелками:
случаях, когда два возможных направления реакции органич. веществ не обусловлены
таутомерией.
Так,
алкили-рование натрийенолятов по атому углерода происходит вследствие перемещения
реакционного центра благодаря сопряжению связей:
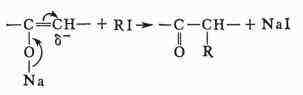
связей проявляется также в ароматич. соединениях (см. Ориентации правила).
При
электрофильном замещении электронодонорные (нуклеофильные) заместители
(VI) ориентируют в орто-и пара-положения, электроноакцепторные (электрофильные)
заместители (VII) - в леша-положение:
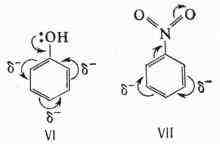
представлений разнообразные процессы О. х. нашли естеств. объяснение. Теоретич.
представления О. х. окрепли и получили предсказательные возможности.
методов исследования был окончательно решён вопрос о строении ароматич.
систем, ъ т. ч. и бензола. Строение последнего описывается следующим образом:
шесть атомов углерода бензольного кольца находятся в одной плоскости и
соединены а-связями; шесть я-электронов составляют единую подвижную электронную
систему. Следствием этого является полная подтверждаемая опытом равноценность
связей С - С и высокая симметрия бензола с осью шестого порядка. Из этих
положений следует, что бензол неполярен и обладает анизотропией диамагнитной
восприимчивости. Аналогичными свойствами характеризуются все ароматич.
системы, у к-рых число я-электронов равно 4n + 2 (правило Хюккеля). Бензол
- далеко не единичный пример соединений с выравненными двойными и простыми
связями; аналогичная картина наблюдается у трополона, тропилийбромида,
ферроцена, дифенилполиенов и др. Вполне удачного графич. изображения строения
бензола и др. ароматич. соединений выработать не удалось. Для описания
их строения используют набор валентных схем (VIII), впервые предложенных
Л. Политом в его резонанса теории, или систему обозначения
(IX), где изогнутые стрелки показывают также выравненность связей (впервые
применена в теории мезомерии):
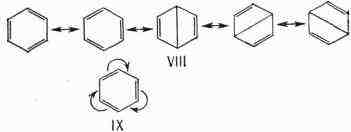
интерпретации равномерного распределения электронной плотности в симметричных
ионах, напр, в карбоксилат-анионе (соответственно X и XI), при объяснении
слабоосновных свойств амидов кислот (XII и XIII) и в др. случаях:
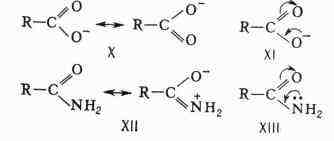
вступила в новую фазу. Многие направления её развивались столь интенсивно,
что выросли в большие специализированные разделы, наз. по научному или
прикладному признаку (стереохимия, химия
полимеров, природных веществ,
антибиотиков,
витаминов, гормонов, металлоор-ганических соединений, фторорганических
соединений, красителей
и др.).
(напр., рентгенографии молекул, ультрафиолетовой и инфракрасной
спектроскопии, раманспектроскопии, ядерного магнитного резонанса,
химически
индуцированной динамической поляризации ядер, масс-спектрометрии), а также
методов идентификации и разделения различных веществ с помощью
хроматографии
сделали
возможным быстрый структурный анализ сложнейших органич. соединений и быстрое
решение многих важных проблем. Применение физ. методов для исследования
кинетики реакций органич. веществ (см. Кинетика химическая) позволяет
изучать реакции с периодом полупревращения 10-8-10-9сек.
Корреляционные уравнения, основанные на принципе линейности свободной энергии,
дают возможность количеств, оценки зависимостей между строением и реакционной
способностью органич. соединений, даже тех, к-рые обладают физиол. действием.
естеств. науками - биохимией, медициной и биологией; применение
идей и методов О. х. в этих науках в значит, степени обусловило развитие
нового направления - молекулярной биологии.
сыграли важную роль в установлении строения нуклеиновых кислот, многих
белков,
сложных
природных соединений; с их же помощью были раскрыты механизм и регуляция
синтеза белков (см. Генетический код). Чрезвычайно возросли синтетич.
возможности О. х., к-рые привели к получению таких сложно построенных природных
веществ, как хлорофилл,витамин Bi
полинуклеотиды
с определённым чередованием звеньев (А. Тодд, X. Г. Корана) и
др. Огромный успех этих методов - разработка автоматического синтеза многих
полипептидов, в том числе и ферментов.
образованных сплетением двух или более циклич. молекул подобно обычной
цепи (к а т е н а н ы, на схеме слева) или подобно гантели, на ось к-рой
надето кольцо (ротаксаны, справа):
силами. Наиболее значит, достижением синтетич. О. х. и биохимии можно считать
синтез гена, к-рый осуществил X. Г. Корана с сотрудниками (1967-70).
в современной технологии произ-ва каучуков синтетических, пластических
масс, волокон синтетических, красителей, медикаментов, в пром-сти кинофотоматериалов,
стимуляторов роста растений, средств борьбы с вредителями с. х-ва (пестицидов)
и
мн. др. Успехи О. х. в области основного органического синтеза
и
нефтехимического синтеза не только изменили технологию ряда произ-в,
но и привели к созданию новых видов продукции. Благодаря установлению зависимостей
между строением и свойствами органич. соединений становится возможным создание
новых материалов различных назначений с заранее заданными свойствами. О.
х. достигла такого уровня, к-рый отвечает её важной роли в создании материальной
культуры совр. общества.
издания. Науч. работу по О. х. в СССР проводят н.-и. ин-ты АН СССР - Ин-т
органич. химии им. Н. Д. Зелинского (ИОХ), Ин-т органич. и физич. химии
им. А. Е. Арбузова (ИОФХ), Ин-т нефтехимич. синтеза им. А. В. Топчиева
(ИНХС), Ин-т элемен-тоорганич. соединений (ИНЭОС), Ин-т химии природных
соединений им. М. М. Шемякина (ИХПС); Сибирского отделения АН СССР - Новосибирский
ин-т органич. химии (НИОХ), Иркутский ин-т органич. химии (ИИОХ), Ин-т
химии нефти; респ. академий - ин-ты органич. химии Арм. ССР, Кирг. ССР,
УССР, Ин-т тонкой органич. химии им. А. Л. Мнджояна (Арм. ССР), Ин-т фи-зико-органич.
химии (БССР), Ин-т физич. и органич. химии им. П. Г. Мелики-швили (Груз.
ССР), Ин-т органич. синтеза (Латв. ССР) и др.
Междунар. союза чистой и прикладной химии (International Union of Pure
and Applied Chemie, IUPAC, ЮПАК), к-рый организует 1 раз в 2 года конгрессы,
конференции и симпозиумы, в частности и по О. х.
работы по О. х.: в С С С Р - "Журнал органической химии" (с 1965); "Журнал
общей химии" (с 1931); "Химия гетероциклических соединений" (Рига, с 1965);
"Химия природных соединений" (Ташкент, с 1965); "Экспресс-информация. Промышленный
органический синтез" (с 1960); за рубежом -"Journal of Organic Chemistry"
(Wash., с 1936); "Journal of the Chemical Society. Perkin Transaction.
I. Organic and Bio-organic Chemistry" (L., с 1972); II. "Physical Organic
Chemistry" (L., с 1972); "Justus Liebigs Annalen der Chemie" (Weinheim,
с 1832); "Bulletin de la Societe chimique de France", pt. 2 (P., с 1858);
"Journal of the Society of Organic Synthetic Chemistry of Japan" (Tokyo,
с 1943); международные - "Tetrahedron" (N. Y., с 1957); "Tetrahedron Letters"
(L., с 1959); "Synthesis" (Stuttgart, с 1969); "Synthetic Communication"
(N. Y., с 1971); "Journal of the Organo-metallic Chemistry" (Lausanne,
с 1964); "Journal of Heterocyclic Chemistry" (L., с 1964); "Organic Magnetic
Resonances- (L., 1969); "Organic Mass Spectrometry" (L., 1968); "Organic
Preparations and Procedures" (N. Y., с 1969). Лит-рапоО. х. реферируется
в журналах: "Chemical Abstracts" (Easton, с 1907), реферативный журнал
"Химия" (с 1953), "Chemisches Zentralblatt" (совместно ГДР и ФРГ, В., с
1830).
полному изучению органической химии, в. 1-3, Каз.,1864-66; его же, Избр.
работы по органической химии, М., 1951; Марковников В. В., Избр. труды,
М., 1955; Г ь е л ь т Э., История органической химии с древнейших времён
до настоящего времени, пер. с нем., Хар.- К., 1937; Ш о р л е м-м е р К.,
Возникновение и развитие органической химии, пер. с англ., М., 1937; Д
ж у а М., История химии, пер. с итал., М., 1966; Road's chemistry of carbon
compounds, 2 ed., v. .1 - 2, Amst. - [a. o.], 1964-1968; Beilsteins Handbuch
der organischen Chemie, 4 Aufl., bearb. von B. Prager [u. a.], Bd 1 - 34,
В., 1918 - 1944 (с 1928 года изд. доп. тт.); Н о u b е n-W е у 1, Methoden
der organischen Chemie, 4 Aufl., Bd 1 - 12, Stuttg., 1953-68; Краткая химическая
энциклопедия, т. 1-5, М., 1961 - 67; Несмеянов А. Н., Несмеянов Н. А.,
Начала органической химии, т. 1 - 2, М., 1969-70; Н е н и ц е с к у К.
Д., Органическая химия, пер. с рум., т. 1 - 2, М., 1962-63; Р о б е р тс
Дж., К а с е р и о М., Основы органической химии, пер. с англ., ч. 1 -
2, М., 1968; Ф и з е р Л., Физер М., Органическая химия, пер. с англ.,
М., 1966; Ч и ч и б а б и н А. Е.„ Основные начала органической химии,
т. 1 - 2, М., 1957 - 63; Ин гольд К., Теоретические основы органической
химии, пер. с англ., М., 1973; Перспективы развития органической химии,
под ред. А. Тодда, пер. с англ., М., 1959. II. Л. Кнунянц.