НОМЕНКЛАТУРА ХИМИЧЕСКАЯ
система
рациональных названий химически индивидуальных веществ. Первая такая система
была выработана в 1787 Комиссией франц. химиков под председательством А.
Л. Лавуазье. До этого названия веществ давались произвольно: по
случайным признакам, по способам получения, по имени первооткрывателя и
т. п. Каждое вещество имело по нескольку названий-синонимов. Комиссия Лавуазье
постановила, что каждое вещество может иметь только одно название; наименование
сложного вещества состоит из двух слов, указывающих на род и вид соединения,
должно быть удобопроизносимым и не противоречить нормам языка. Н. х., предложенная
франц. учёными и основанная на кислородной теории (см. Кислород), явилась
образцом для создания в нач. 19 в. нац. номенклатур, в т. ч. русской. Совр.
номенклатура неорганических соединений и номенклатура органических соединений
разработаны междунар. комиссиями, стремившимися выразить словами всю информацию,
содержащуюся в формулах химических. Задача эта чрезвычайно сложная.
При пользовании т. н. международной Н. х. следует помнить высказывание
А. М. Бутлерова (1859) о русской Н. х.: "большею частью своей массы
она сольется с общею химической номенклатурой, а русские названия, выработавшиеся
в обыденном языке, как были, так и останутся в употреблении у русских химиков"
(Соч., т. 3, 1958, с. 143). По мнению Д. И. Менделеева (1869), "...
в деле номенклатуры нельзя быть совершенно последовательным: есть известного
рода обычаи ..., от которых отступить невозможно, иначе рискуешь быть непонятым
даже теми, кто привык уже к химическому изложению. Из разных названий,
более или менее рационально составленных, нужно избрать ... не только такое,
которое более ясно выражает особенность или состав данного вещества, но
также и такое, которое не поражает ухо своим неудобством" (Соч., т. 13,
1949, с. 28.3).
Номенклатура неорганических соединений
(Н.
н. с.). Главные положения рус. Н. н. с. создали химики 1-й пол. 19 в.,
в частности В. М. Севергин и гл. обр. Г. И. Гесс
с сотрудниками
(1831, 1835). Эта Н. н. с., переработанная Менделеевым (1861, 1869), была
общеупотребительна (с нек-рыми поправками) вплоть до 1930-х гг., когда
сов. химики стали предпочитать т. н. международные названия, заимствованные
из зап.-европ. языков. Приводимые ниже осн. положения Н. н. с. составлены
с учётом названий, применяемых в научной и учебной хим. литературе. Эти
положения отражают переходное состояние Н. н. с., существующее в
60- нач. 70-х гг.
Основой Н. н. с. служат названия хим. элементов
(см. Знаки химические). Как правило, название соединения состоит
из двух слов. Одно из них означает принадлежность данного соединения к
определённому роду (или классу), другое - к определённому виду. Напр.,
в названии "серная кислота" существительное показывает, что данное вещество
относится к кислотам, а прилагательное поясняет, что это кислота,
образованная серой в высшей степени окисления. Название "сульфат натрия"
говорит, что вещество принадлежит к сульфатам (солям серной кислоты) и
представляет собой соль натрия.
В Н. н. с. применяют корни гл. обр. лат.
названий элементов, отличающиеся от русских (табл. 1).
|
Антнмон
Аргент Арсен Аур Гидр Карбкарбон Купр Мангана Меркур Нитр Окс Плюмб Силик Станн Стиб Сульф Тио Ферр |
(antimonium
- сурьма) (argentum - серебро) (arsenicum - мышьяк) (aurum - золото) (hydrogenium - водород) (carboneum - углерод) (cuprum - медь) (manganum - марганец) (mercurius - ртуть) (nitrogenium - азот) (oxygenium - кислород) (plumbum - свинец) (silicium - кремний) (stannum - олово) (stibium - сурьма) (sulphur - сера) (греч. theion - сера) (ferrum - железо) |
Название радикалов (атомных групп, переходящих
В названиях соединений, состоящих из атомов
По РН вместо суффикса -ид применяют суффиксы
Соединения элементов с кислородом, в к-рых
По РН назв. кислородных кислот составляют
Таблица 2 * От лат. sesqui - полтора. Назв. солей по МН составляются из
Лит.: Лучинский Г. П., Номенклатура
Научное назв. органич. вещества должно
В зависимости от выбранной основы названия
Рациональная номенклатура под назв. "радикально-функциональной"
В назв. соединений с несколькими разными
* Функции расположены в порядке убывания
Примерами таких назв. могут служить:
По соответствующим правилам строят названия
Междунар. правила не фиксируют деталей
Лит.: Справочник химика, [Дополнительный
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
без изменений из одного соединения в другое) составляют из корней лат.
названий элементов и суффикса -ил (от греч. hyle - вещество). Примеры:
гидроксил ОН, карбонил СО. Ист. названия: аммоний NH
двух элементов с ионной или полярной ковалентной связью, на первое место
ставится наименование более электроотрицательной части. По международной
Н. н. с. (МН, в отличие от рус. номенклатуры РН) оно составляется из корня
лат. названия элемента и суффикса -ид (от греч. суффикса -ides, означающего
отчество в собств. именах). На второе место ставится название электроположит.
элемента в родит, падеже (напр., NaCl - хлорид натрия). Степень окисления
электроположит. элемента указывают либо римской цифрой в скобках (что предпочтительнее),
либо приставками, заимствованными из греч. крличественных числительных:
геми-(полу-), моно-(1), ди-(2), три-(З), тетра-(4), пента-(5), гекса-(6),
гепта-(7), окто-(8), нона-(9), дека-(10). Примеры: FeCl
-истый для указания либо единственной, либо низшей степени окисления и
-ный (иногда -овый, -евый) для высшей степени окисления. Для обозначения
степени окисления также пользуются русскими числительными и римскими цифрами.
Примеры: NaCl - хлористый натрий; FeCl
он связан только с более электроположит. атомами, наз. по МН оксидами,
по РН - окислами. В порядке возрастания степени окисления электроположит.
элемента окислам либо дают названия закись, окись, двуокись, трёхокись,
либо указывают римской цифрой степень окисления. Окислы, к-рые можно получить
отнятием воды от кислот, наз. ангидридами (МН отменяет этот термин).
В табл. 2 сопоставлены названия окислов хрома по МН и РН. Соединения, в
к-рых атомы кислорода связаны и друг с другом, и с атомами более электроположит.
элемента, наз. пероксидами или перекисями (см. Перекисные соединения).
Примеры:
пероксид (перекись) водорода Н - О - О - Н, пероксид бария
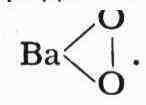
Соединения неметаллов с водородом, водные
растворы к-рых имеют характер кислот, наз. сочетанием корня рус. названия
элемента и слова водород, напр. НС1 - хлороводород, H
гидрид (дигидрид) кальция СаН
из корня рус. названия кислотообразующего элемента и суффиксов -ная, -овая
(для высшей степени окисления), -истая, -оватая, -оватистая (для низших
степеней окисления в убывающем порядке). Примеры: НС1О
и той же степени окисления, но содержащие неодинаковое число молекул воды,
различаются приставками орто- (греч. orthos-прямой) для кислоты с наибольшим
содержанием воды и мета- (греч. meta - после) - с наименьшим. Примеры:
Н
элемента в одной и той же степени окисления, наз. изополикислотами; число
атомов этого элемента указывают русской (иногда греч.) приставкой. Примеры:
H
Н. н. с.
с.
моноксид хрома
окись хрома (П), одноокись хрома
дихром триок-сид, гемитриок-сид хрома, сес-квиоксид* хрома
окись хрома (III), полутора-окись хрома
триоксид хрома
окись хрома (VI), трёх-окись хрома
Основания наз. по МН гидроксидами,
по РН - гидроокисями. Если металл образует свыше одного основания, степень
окисления металла указывают либо римской цифрой в скобках, либо приставкой
- рус. или греческой. Примеры: Fe(OH)
закиси", "гидрат окиси" выходят из употребления.
названий аниона в именит, падеже и катиона в родит, падеже. Назв. анионов
кислородных кислот составляют из корня лат. названия кислотообразующего
элемента и суффиксов: -ат для высшей степени окисления и -ит - для низшей.
Примеры: SO
сульфат -ион, K
- сульфит-ион, Na
то название аниона, в к-ром эта степень наивысшая, имеет суффикс -ат и
приставку пер- (лат. приставка per означает усиление); следующие степени
окисления в убывающем порядке указываются суффиксами -ат, -ит и, наконец,
-ит и приставкой гипо- (греч. приставка hypo означает ослабление качества).
Примеры: С1O
- хлорат-ион, С1О
В названиях солей степень окисления катиона указывают римскими цифрами
в скобках: FeSO
обе приставки; PO
- мета-фосфат-ион. Названия анионов кислых солей имеют приставку гидро-,
напр.: НSО
- дигидроортофосфат-ион. Названия катионов основных солей имеют приставку
гидроксо- [напр.: MgOH+ - гидроксомагний-ион, Bi(OH)
- дигидроксовисмут(Ш)-ион] или оксо-[VО+ - оксованадий(III)-ион].
Нередко применяют нерекомендуемые названия солей, такие, как NaНСО
квасцы,
купоросы, селитры.
неорганических соединений, в кн.: Краткая химическая энциклопедия, т. 3,
М., 1964; Материалы к проекту номенклатуры неорганических соединений, М.,
1968; Некрасов Б. В., Основы обшей химии, 2 изд., т. 1, М., 1969; Лабораторный
практикум по общей химии, под ред. С. А. Погодина, 2 изд., М., 1972, с.
27-33; Б у с е в А. И., Е ф и м о в И. П., Словарь химических терминов.
Пособие
о s 1 a n d M. P., Historical studies in the language of chemistry, L.,
1962. С. А. Погодин.
Номенклатура органических соединений
(Н. о. с.). В начальный период развития органич. химии вещества получали
случайные, тривиальные назв., основой к-рых служили природные источники,
характерные свойства веществ, имена учёных. Такие назв. в ряде случаев
сохранились и до сих пор.
отражать его химич. строение. Для этого употребляют сложные слова-названия,
построенные по определённым правилам из обозначений более простых составных
частей соединения и цифр или букв, указывающих расположение этих частей.
Первой была постепенно сложившаяся во 2-й пол. 19 в. рациональная номенклатура.
Основу рационального назв. составляет простой (но не обязательно первый)
член данного гомологического ряда; назв. "достраивают", указывая
дополнительно (в приставке) имеющиеся радикалы и др. структурные части;
их положение обозначают греч. буквами. Примерами могут служить след. названия
(принятая за основу названия часть молекулы выделена в формулах пунктиром):
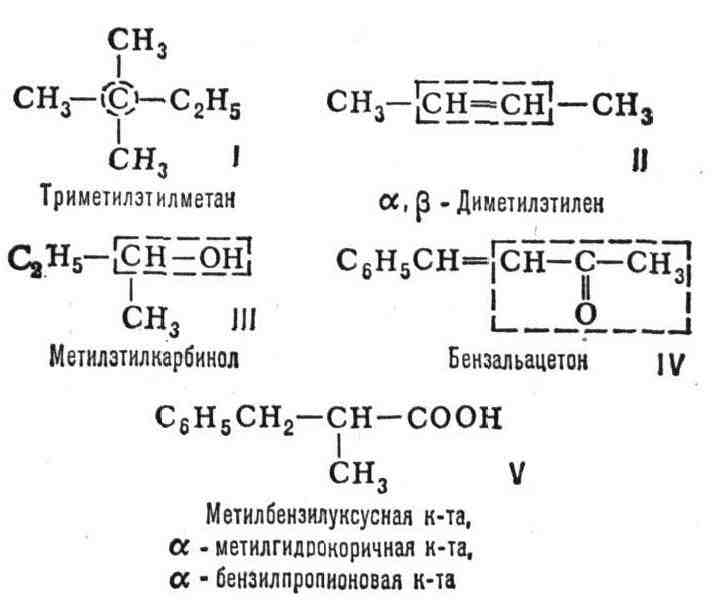
одно вещество может иметь и несколько рациональных названий, как в примере
V.
стала составной частью современной Н. о. с.- правил Междунар. союза чистой
и прикладной химии (правил IUPAC), принятых в 50 - 60-х гг. 20 в. Другая
составная часть этих правил - заместительная номенклатура, представляет
собой дальнейшее развитие Женевской и Льежской номенклатур. Основой назв.
по заместительной номенклатуре служит главная углеродная цепь и главная
функциональная группа (функция, см. табл. 3). При помощи спец. приставок
и суффиксов указывают имеющиеся в формуле дополнит, радикалы, кратные связи,
др. функции. Их число обозначают соответствующими числительными (ди-, три-,
тетра- и т. д.), а положение - номером соответствующего атома главной цепи.
Последнюю обозначают корнем названия соответствующего углеводорода (C
цепь), -ен (двойная связь), -ин (тройная связь), боковые цепи - названиями
соответствующих радикалов. Приведённые выше соединения получат по заместительной
номенклатуре IUPAC след, названия: (I) - 2,2-диметилбутан; (II) - 6утен-2;
(III)- бутанол-2; (IV)- 4-фенилбутен-З-он-2; (V) - З-фенил-2-метилпропановая
кислота.
функциями в суффиксе оставляют обозначение только гл. функции, а остальные,
как и боковые цепи (радикалы), перечисляют в приставке (префиксе). При
этом одна и та же функция в суффиксе (как старшая) и в префиксе (как младшая)
имеет разные обозначения (см. табл. 3).
наиболее часто встречающихся ф у н к ц и й
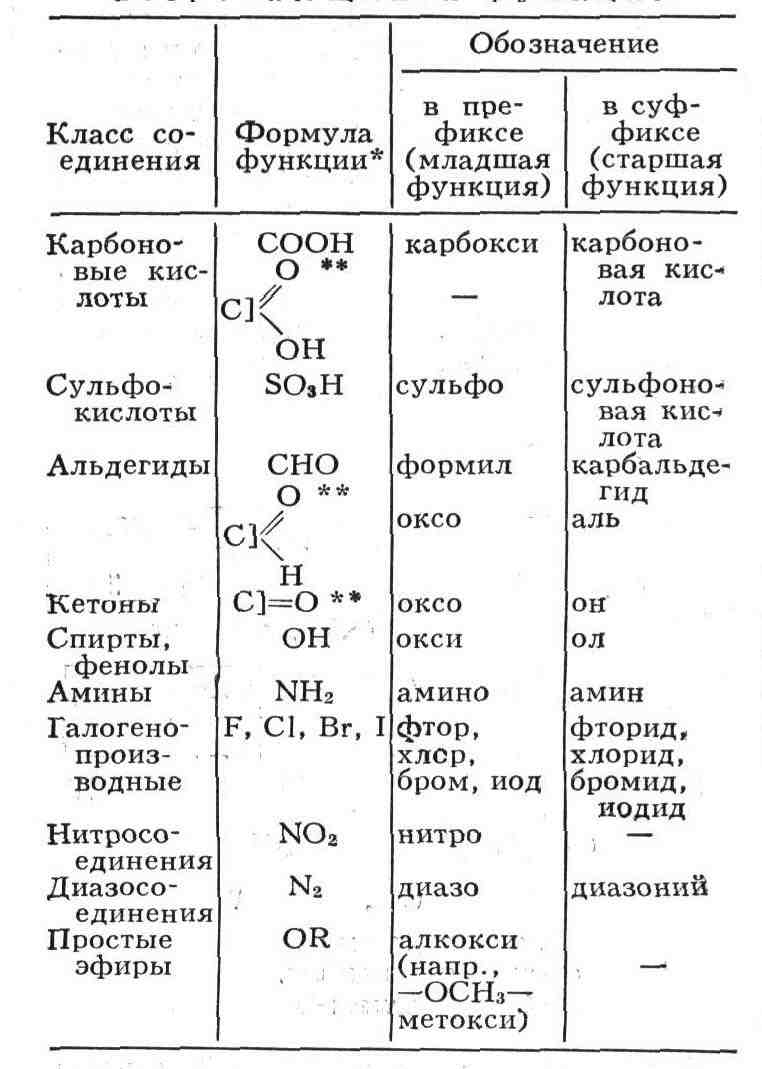
старшинства. ** При употреблении этого варианта названий углерод функциональной
группы (отделённый условно квадратной скобкой) считается составной частью
углеродной цепи.
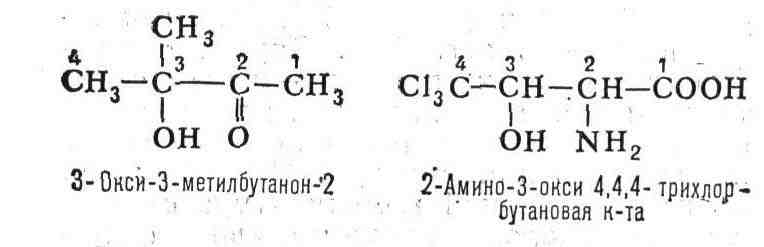
циклических (алициклических, ароматических, гетероциклических) и элементоорганич.
соединений, стереоизомеров. Часто при этом используют т. н. заменительную
номенклатуру (а-номенклатуру), по к-рой стоящие в цепи неуглеродные атомы
обозначают корнями их латинских назв. с окончанием "а", напр.:
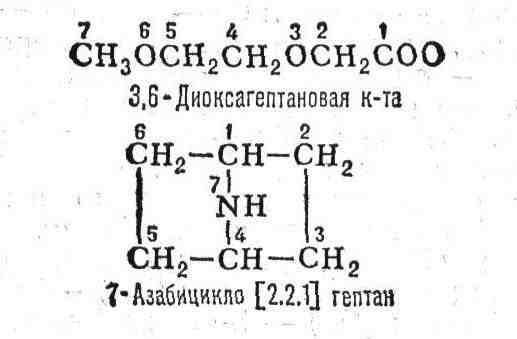
написания названий (слитно или через чёрточки, расположение цифровой части,
употребление точек или запятых и т. д.), оставляя это на усмотрение отд.
стран в соответствии с языковыми особенностями и традициями.
том], Л., 1968; Номенклатура органичеч ских соединений, М., 1955. В.
М. Потапов.