НИКЕЛЬ
(лат. Niccolum),
Ni, хим. элемент первой триады VIII группы перио-дич. системы Менделеева,
ат. н. 28, ат. м. 58,70; серебристо-белый металл, ковкий и пластичный.
Природный H. состоит из смеси пяти стабильных изотопов: 58Ni
(67,76%), 60Ni (26,16%), 61Ni (1,25%), 63Ni
(3,66%), 64Ni (1,16%). Историческая справка. Металл в нечистом
виде впервые получил в 1751 швед, химик А. Кронстедт, предложивший
и назв. элемента. Значительно более чистый металл получил в 1804
нем. химик И. Рихтер. Назв. "Н." происходит от минерала купферникеля (NiAs),
известного уже в 17 в. и часто вводившего в заблуждение горняков внеш.
сходством с медными рудами (нем. Kupfer - медь, Nickel - горный дух, якобы
подсовывавший горнякам вместо руды пустую породу). С сер. 18 в. H. применялся
лишь как составная часть сплавов, по внешности похожих на серебро. Широкое
развитие никелевой пром-сти в кон. 19 в. связано с нахождением крупных
месторождений никелевых руд в Новой Каледонии и в Канаде и открытием "облагораживающего"
его влияния на свойства сталей.
Распространение в природе.
H.- элемент земных глубин (в ультраосновных породах мантии его 0,2% по
массе). Существует гипотеза, что земное ядро состоит из никелистого железа;
в соответствии с этим среднее содержание H. в земле в целом по оценке ок.
3%. В земной коре, где H. 5,8·10-3%, он также тяготеет к более
глубокой, т. н. базальтовой оболочке. Ni в земной коре - спутник Fe и Mg,
что объясняется сходством их валентности (II) и ионных радиусов; в минералы
двухвалентных железа и магния H. входит в виде изоморфной примеси. Собственных
минералов H. известно 53; большинство из них образовалось при высоких темп-pax
и давлениях, при застывании магмы или из горячих водных растворов. Месторождения
H. связаны с процессами в магме и коре выветривания. Пром. месторождения
H. (сульфидные руды) обычно сложены минералами H. и меди (см. Никелевые
руды). На земной поверхности, в биосфере H.- сравнительно слабый мигрант.
Его относительно мало в поверхностных водах, в живом веществе. В районах,
где преобладают ультраосновные породы, почва и растения обогащены никелем.
Физические и химические свойства.
Ферромагнетизм Н.
В хим. отношении Ni сходен
С азотом H. не реагирует
В ряду напряжений Ni стоит
При взаимодействии с кислотами
При повышенных темп-pax H.
Получение. Ок. 80% H. от
Для разделения Cu и Ni используют
В совр. "автогенных" процессах
Из силикатных (окисленных)
Применение. Подавляющая часть
Значит, количество H. расходуется
Переработка руд H. сопровождается
Никель в организме является
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
При обычных условиях H. существует в виде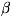 -модификации,
-модификации,
имеющей гранецентрированную кубич. решётку (а = 3,5236 А). Но H.,
подвергнутый катодному распылению в атмосфере H
имеющую гексагональную решётку плотнейшей упаковки (а =· 2,65 А,
с
= 4,32 А), к-рая при нагревании выше 200 0C переходит в
кубическую. Компактный кубич. H. имеет плотность 8,9 г/см3(20
0C), атомный радиус 1,24 А, ионные радиусы: Ni2+
0,79 A, Ni3+ 0,72 A; t
t
ок. 3000 0C; удельная теплоёмкость при 20 0C 0,440
кджДкг-К) [0,105 кал/(г· 0C)]; температурный коэфф. линейного
расширения 13,3· Ю-6 (0-100 0C); теплопроводность
при 25 0C 90,1 вт/(м-К) [0,215 кал! (см-сек-°С)];
тоже при 500 0C 60,01 вm/(л-К) [0,148 кал/ (см· сек·
C0)]. Удельное электросопротивление при 20 0C
68,4 ном-м, т.е. 6,84 мком-см; температурный коэфф. электросопротивления
6,8-Ю-3 (0-100 0C). H.- ковкий и тягучий металл,
из него можно изготовлять тончайшие листы и трубки. Предел прочности при
растяжении 400-500 Мн/м2 (T е. 40-50 кгс/мм2);
предел
упругости 80 Мн/м2, предел текучести 120 Мн/м2;
относит, удлинение 40%; модуль нормальной упругости 205 Гн/м2;
твёрдость
по Бринеллю 600- 800 Мн/м2. В температурном интервале
от О до 631 К (верхняя граница соответствует Кюри точке) H. ферромагнитен.
обусловлен особенностями строения внеш. электронных оболочек (3d84
s2) его атомов. H. вместе с Fe (3 d°4s2) и Со (3d74s2),
также ферромагнетиками, относится к элементам с недостроенной 3d-электронной
оболочкой (к переходным 3d-металлам). Электроны недостроенной оболочки
создают нескомпенсированный спиновый магнитный момент, эффективное значение
к-рого для атомов H. составляет 6 ЦБ, где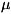
кристаллах H. приводит к параллельной ориентации атомных магнитных моментов,
т. е. к ферромагнетизму. По той же причине сплавы и ряд соединений H. (окислы,
галогениды и др.) магнито-упорядочены (обладают ферро-, реже ферримагнитной
структурой, см. Магнитная структура). H. входит в состав важнейших
магнитных
материалов и сплавов с минимальным значением коэфф. теплового расширения
(пермаллой, монелъ-металл, инвар и др.).
с Fe и Со, но также и с Cu и благородными металлами. В соединениях проявляет
переменную валентность (чаще всего 2-валентен). H.- металл средней активности.
Поглощает (особенно в мелкораздробленном состоянии) большие количества
газов (H
в мелкодисперсном состоянии H. пирофорен - на воздухе самовоспламеняется.
Из окислов наиболее важна закись NiO - зеленоватые кристаллы, практически
нерастворимые в воде (минерал бунзенит). Гидроокись выпадает из растворов
никелевых солей при прибавлении щелочей в виде объёмистого осадка яблочно-зелёного
цвета. При нагревании H. соединяется с галогенами, образуя NiX
даже при высоких темп-pax (до 1400 0C). Растворимость азота
в твёрдом H. приблизительно 0,07% по массе (при 445 0C). Нитрид
Ni
паров фосфора при высокой темп-ре образуется фосфид Ni
Ni
гексагональную упаковку, все октаэдрич. пустоты к-рой заняты атомами Ni)
обладают многие металлиды. Неустойчивый карбид Ni
H. в атмосфере СО при 300 0C. В жидком состоянии H. растворяет
заметное кол-во С, выпадающего при охлаждении в виде графита. При выделении
графита H. теряет ковкость и способность обрабатываться давлением.
правее Fe (их нормальные потенциалы соответственно - 0,44 в и -0,24
в)
и поэтому медленнее, чем Fe, растворяется в разбавленных кислотах.
По отношению к воде H. устойчив. Органич. кислоты действуют на H. лишь
после длит, соприкосновения с ним. Серная и соляная к-ты медленно растворяют
H.; разбавленная азотная - очень легко; концентрированная HNO
образуются соли 2-валентного Ni. Почти все соли Ni (II) и сильных кислот
хорошо растворимы в воде, растворы их вследствие гидролиза имеют кислую
реакцию. Труднорастворимы соли таких сравнительно слабых кислот, как угольная
и фосфорная. Большинство солей H. разлагается при прокаливании (600- 800
0C).
Одна из наиболее употребительных солей - сульфат NiSO
в аммиачных растворах в присутствии (NHO
большинства из них характерно наличие комплексов [Ni(NHa)
и [Ni(OH)
NaOCl и NaOBr осаждают из растворов солей Ni (II), гидроокись Ni(OH)
2-валентен. Комплексное соединение Ni с диметилглиоксимом (C
взаимодействует с окислами азота, SO
карбонил Ni(CO)4 (CM. Карбонилы металлов). Термич. диссоциацией
карбонила получают наиболее чистый H.
общего его произ-ва (без СССР) получают из сульфидных медно-никелевых руд.
После селективного обогащения методом флотации из руды выделяют медный,
никелевый и пирротиновый концентраты. Никелевый рудный концентрат в смеси
с флюсами плавят в электрич. шахтах или отражательных печах с целью отделения
пустой породы и извлечения H. в сульфидный расплав (штейн), содержащий
10-15% Ni. Обычно электроплавке (осн. метод плавки в СССР) предшествуют
частичный окислит, обжиг и окускование концентрата. Наряду с Ni
в штейн переходят часть Fe, Со и практически полностью Cu и благородные
металлы. После отделения Fe окислением (продувкой жидкого штейна в конвертерах)
получают сплав сульфидов Cu и Ni - файнштейн, к-рый медленно охлаждают,
тонко измельчают и направляют на флотацию для разделения Cu и Ni. Никелевый
концентрат обжигают в кипящем слое до NiO. Металл получают восстановлением
NiO в электрич. дуговых печах. Из чернового H. отливают аноды и рафинируют
электролитически. Содержание примесей в электролитном H. (марка 110) 0,01%.
также т. н. карбонильный процесс, основанный на обратимости реакции: Ni
+ + 4CO <=> Ni(CO)
и при 200-250 0C, а его разложение - без доступа воздуха
при атм. давлении и ок. 200 0C. Разложение Ni(CO)
изделий (разложение на нагретой матрице).
плавка осуществляется за счёт тепла, выделяющегося при окислении сульфидов
воздухом, обогащённым кислородом. Это позволяет отказаться от углеродистого
топлива, получить газы, богатые SO
процесса. Наиболее совершенно и перспективно окисление жидких сульфидов.
Всё более распространяются процессы, основанные на обработке никелевых
концентратов растворами кислот или аммиака в присутствии кислорода при
повышенных темп-pax и давлении (автоклавные процессы). Обычно H. переводят
в раствор, из к-рого выделяют его в виде богатого сульфидного концентрата
или металлич. порошка (восстановлением водородом под давлением).
руд H. также может быть сконцентрирован в штейне при введении в шихту плавки
флюсов - гипса или пирита. Восстановительно-сульфидирующую плавку проводят
обычно в шахтных печах; образующийся штейн содержит 16-20% Ni, 16-18% S,
остальное - Fe. Технология извлечения H. из штейна аналогична описанной
выше, за исключением того, что операция отделения Cu часто выпадает. При
малом содержании в окисленных рудах Со их целесообразно подвергать восстановит,
плавке с получением ферроникеля, направляемого на произ-во стали. Для извлечения
H. из окисленных руд применяют также гидрометаллургич. методы - аммиачное
выщелачивание предварительно восстановленной руды, сернокислотное автоклавное
выщелачивание и др.
Ni используется для получения сплавов с др. металлами (Fe, Cr, Cu и др.),
отличающихся высокими механич., антикоррозионными, магнитными или электрич.
и термоэлектрич. свойствами. В связи с развитием реактивной техники и созданием
газотурбинных установок особенно важны жаропрочные и жаростойкие хромоникелевые
сплавы (см. Никелевые сплавы). Сплавы H. используются в конструкциях
атомных реакторов.
для произ-ва щелочных аккумуляторов и антикоррозионных покрытий. Ковкий
H. в чистом виде применяют для изготовления листов, труб и т. д. Он используется
также в хим. пром-сти для изготовления спец. хим. аппаратуры и как катализатор
многих хим. процессов. H.- весьма дефицитный металл и по возможности должен
заменяться другими, более дешёвыми и распространёнными материалами.
выделением ядовитых газов, содержащих SO
весьма ядовит и легко летуч Ni(CO)
вентиляция. А. В. Ванюков.
необходимым микроэлементом. Среднее содержание его в растениях 5,0х10-5%
на сырое вещество, в организме наземных животных 1,0-10°%, в морских-1,6х10-4%.
В животном организме H. обнаружен в печени, коже и эндокринных железах;
накапливается в ороговевших тканях (особенно в перьях). Физиология, роль
H. изучена недостаточно. Установлено, что H. активирует фермент аргиназу,
влияет на окислит, процессы; у растений принимает участие в ряде ферментативных
реакций (карбо-ксилирование, гидролиз пептидных связей и др.). На обогащённых
H. почвах содержание его в растениях может повыситься в 30 раз и более,
что приводит к эндемич. заболеваниям (у растений - уродливые формы, у животных
- заболевания глаз, связанные с повышенным накоплением H. в роговице: кератиты,
кератоконъюнктивиты). и. Ф. Грибовская. Лит.: РипанР., Четяну И.,
Неорганическая химия, т. 2 - Металлы, пер. с рум., M., 1972, с. 581-614;
Справочник металлурга по цветным металлам, т. 2 - Цветные металлы, M.,
1947 (Металлургия никеля, с. 269-392); В о и н а р А. И., Биологическая
роль микроэлементов в организме животных и человека, 2 изд., M., 1960;
Биологическая роль микроэлементов и их применение в сельском хозяйстве
и медицине, т. 1-2, Л., 1970.