НЕРЛЬ
посёлок гор. типа в Тейковском
р-не Ивановской обл. РСФСР. Ж.-д. станция на линии Иваново - Александров.
Ткацкая ф-ка.
HEPHCT (Nernst) Вальтер Фридрих
Герман (25.6.1864, Бризен, ныне Вомб-жезьно, Польша,- 18.11.1941, Обер-Цибелле,
близ Мускау, ныне ГДР), немецкий физик и физико-химик, один из осно-аателей
совр. физической химии. В 1883-87 учился в ун-тах Цюриха, Берлина, Граца
и Вюрцоурга; специализировался по физике у Л. Болъцмана и Ф. Колърауша.
Под
влиянием С. Арре-ниуса решил посвятить себя физ. химии и в 1887
поступил на должность ассистента у В. Оствалъда в Лейпцигском ун-те.
В 1890 приват-доцент и с 1891 проф. Гёттингенского ун-та, в 1896 основал
при ун-те Физико-химический ин-т; в 1902- 1933 проф. Берлинского ун-та,
там же директор Ин-та химии (1905-22) и Ин-та физики (1924-33).
В дипломной работе, выполненной в лаборатории
H.- автор учебного руководства по теоретич.
Лит.: Hoffmann Fr., Walter Nernst
Другая эквивалентная формулировка H.
H. т. приводит к ряду важных термодинамич.
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
А. Эттингсхаузена, H. описал обнаруженный им эффект возникновения разности
потенциалов в помещённой в магнитное поле металлич. пластинке, через к-рую
проходит тепловой поток (см. Нернста - Эттингсхаузена эффект). В
1888-89 установил связь между подвижностью ионов и коэфф. диффузии электролитов,
что послужило основой для созданной им теории электродвижущих сил гальванич.
элементов. В 1890 был открыт Нернста закон распределения. В 1894
H. показал, что диссоциирующая способность растворителя тем больше, чем
выше значение его диэлектрич. проницаемости, и обнаружил явление электрострикции.
Изучая тепловые процессы при низких темп-pax, H. пришёл к формулировке
принципа (т. н. Нернста теоремы, 1906), согласно к-рому изменение
энтропии тела стремится к нулю, если его темп-pa стремится к нулю. Этот
принцип не вытекает из 1-го и 2-го начал термодинамики и нередко именуется
третьим
началом термодинамики. Исследовав равновесие N
исходя из атмосферного азота, а в 1905-07 синтезировал аммиак из азота
и водорода при высоких темп-pax и давлении с применением марганца как катализатора;
в дальнейшем работы Ф. Габера в этом направлении привели к пром.
синтезу аммиака. В 1918 H., пользуясь представлениями о цепных реакциях,
дал объяснение механизма хим. взаимодействия хлора с водородом.
химии, выдержавшего 15 изданий и переведённого на русский и др. языки;
оно послужило образцом для курсов физ. химии, читавшихся в конце 19 - начале
20 вв. H. опубликовал неск. работ по общим вопросам космологии и физ. описания
Вселенной. H. был членом многих АН, в т. ч. почётным членом АН СССР (1927).
Нобелевская пр. (1920). Соч.: Theoretische Chemie vom Stand-punkte der
Avogadroschen Regel und der Thermodynamik, 15 Aufl., Stuttg., 1926; в рус.
пер. - Теоретическая химия с точки зрения закона Авогадро и термодинамики,
СПБ, 1904; Основания высшей математики, К., 1907 (совм. с А. Шёнфлисом);
Мироздание-в свете новых исследований, M.- П., 1923; Теоретические и опытные
основания нового-теплового закона, М.- Л., 1929.
zum Gedachtnis, "Physikalische Zeitschrift". 1942, Jg. 43, № 7-8, S. 109-16;
В о d e nstein M., Walter Nernst, "Berichte der Deutschen Chemischen Gesellschaft",
1942, Jg. 75, № 6, S. 79 - 104; Соловьёв Ю. И, Из истории физической химии
(Нернст его труды), "Труды Ин-та истории естествознания и техники", 1961,
т. 35, История химических наук, с. 3 - 38; Partingt о n J. R., A history
of chemistry, v. 4, L.
Рожанский.
HEPHCTA ЗАКОН РАСПРЕДЕЛЕНИЯ определяет
относительное содержание в двух несмешивающихся или ограниченно смешивающихся
жидкостях растворимого в них компонента; является одним из законов идеальных
разбавленных растворов. Открыт в 1890 В. Нернстом. Согласно H. з.
р., при равновесии отношение концентраций третьего компонента в двух жидких
фазах является постоянной величиной. H. з. р. может быть записан в виде
с
фазах; постоянная k - коэфф. распределения, зависящий от темп-ры.
H. з. р. позволяет определить более выгодные условия экстрагирования веществ
из растворов.
HEPHCTА ТЕОРЕМА, установленная
В.
Перистом
(1906) теорема термодинамики, согласно к-рой изменение
энтропии
(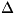 S)
S)
при любых обратимых
изотермических процессах, совершаемых между
двумя равновесными состояниями при темп-pax
T, приближающихся к
абс. нулю, стремится к нулю:
![]()
т.: при помощи конечной последовательности термодинамич. процессов нельзя
достичь темп-ры, равной абс. нулю.
следствий, поэтому её часто наз. третьим началом термодинамики.