МЫШЬЯК
(лат. Arsenicum), As,
химич. элемент V группы периодич. системы Менделеева, ат. н. 33, ат. масса
74,9216; кристаллы серо-стального цвета. Элемент состоит из одного устойчивого
изотопа 75As.
Историческая справка. Природные соединения
Распространение в природе. Среднее содержание
Малые количества M. необходимы для жизни.
В живом веществе в среднем 3·10-5%
Физическиеи химические свойства. M. имеет
Конфигурация внеш. электронов атома M.
Оксид M. (V) получают нагреванием мышьяковой
Получение и применение. M. получают в пром-сти
FeAsS = FeS + As или (реже) восстановлением
Небольшие добавки M. (0,2-1,0% по массе)
Чистый M. не ядовит, но все его соединения,
С. Л. Погодин.
M. в организме. В качестве микроэлемента
M. в медицине. Органические соединения
Полученные искусственно радиоактивные изотопы
Согласно рекомендациям Междунар. комиссии
Меры предупреждения производственных отравлений
Лит.: P е м и Г., Курс неорганической
M., 1964; Вредные вещества в промышленности,
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
M. с серой (аури-пигмент As
и краски. Был известен и продукт обжигания сульфидов M.- оксид M. (III)
As
служило для обозначения соединений M. (по их сильному действию на организм).
Рус. название, как полагают, произошло от "мышь" (по применению препаратов
M. для истребления мышей и крыс). Получение M. в свободном состоянии приписывают
Альберту
Великому (ок. 1250). В 1789 А. Лавуазье включил M. в список
химич. элементов.
M. в земной коре (кларк) 1,7-10-4% (по массе), в таких количествах
он присутствует в большинстве изверженных пород. Поскольку соединения M.
летучи при высоких темп-pax, элемент не накапливается при магматич. процессах;
он концентрируется, осаждаясь из горячих глубинных вод (вместе с S, Se,
Sb, Fe, Со, Ni, Cu и др. элементами). При извержении вулканов M. в виде
своих летучих соединений попадает в атмосферу. Так как M. многовалентен,
на его миграцию оказывает большое влияние окислительно-восстановительная
среда. В окислительных условиях земной поверхности образуются арсенаты
(As5+ ) и арсениты (As3+). Это редкие минералы, встречающиеся
только на участках месторождений M. Ещё реже встречается самородный M.
и минералы As2+. Из многочисленных минералов M. (ок. 180) основное
промышленное значение имеет лишь арсено-пирит FeAsS (см. Мышьяковые
руды).
Однако в районах месторождений M. и деятельности молодых вулканов почвы
местами содержат до 1% M., с чем связаны болезни скота, гибель растительности.
Накопление M. особенно характерно для ландшафтов степей и пустынь, в почвах
к-рых M. малоподвижен. Во влажном климате M. легко вымывается из почв.
M., в реках 3·10-7%. М., приносимый реками в океан, сравнительно
быстро осаждается. В морской воде лишь 1· 10-7% M., но зато
в глинах и сланцах 6,6·10-4%. Осадочные железные руды, железомарганцевые
конкреции часто обогащены M.
несколько алло-тропич. модификаций. При обычных условиях наиболее устойчив
т. н. металлич., или серый, M. (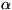 -As)
-As)
- серосталь-ная хрупкая кристаллич. масса; в свежем изломе имеет металлич.
блеск, на воздухе быстро тускнеет, т. к. покрывается тонкой плёнкой As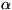
= 54010', х == 0,226), слоистая. Плотность 5,72 г/см3
(при
20 0C), удельное электрич. сопротивление 35-10-8ом·м,
или
35-10-6 ом·см, температурный коэффициент электросопротивления
3,9·10-3 (0°-100 0C), твёрдость по Бринеллю 1470
Мн/м2, или 147 кгс/мм2 (3-4 по Moocy); M.
диамагнитен. Под атмосферным давлением M. возгоняется при 615 0C
не плавясь, т. к. тройная точка (см. Диаграмма состояния)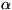 -As
-As
лежит при 816 0C и давлении 36 am. Пар M. состоит до
800 0C из молекул As
только из As
плотностью 1,97 г/см3, похожие по свойствам на белый
фосфор.
При
действии света или при слабом нагревании он переходит в серый M. Известны
также стекловидно-аморфные модификации: чёрный M. и бурый M., к-рые при
нагревании выше 270 0C превращаются в серый M.
3d104s24p3.
B
соединениях M. имеет степени окисления +5, +3 и -3. Серый M. значительно
менее активен химически, чем фосфор. При нагревании на воздухе выше 400
0C
M. горит, образуя As
(смеси HNO
мелких кристаллов кубич. сингонии, плотность 3,865 г/см3.
Плотность
пара отвечает формуле As
пар состоит из As
2,1 г As
- соединение амфотер-ное, с преобладанием кислотных свойств. Известны соли
(арсениты), отвечающие кислотам ортомышьяковистой H
к-ты H
ок. 500 0C разлагается на As
Известны соли, отвечающие кислотам ортомышьяковой H
с металлами M. по большей части образует соединения (арсениды).
нагреванием мышьякового колчедана:
As
ангидрид получают окислит, обжигом мышьяковых руд или как побочный продукт
обжига полиметаллич. руд, почти всегда содержащих M. При окислит, обжиге
образуются пары As
Очищенный As
вводят в свинец, служащий для произ-ва ружейной дроби (M. повышает поверхностное
натяжение расплавленного свинца, благодаря чему дробь получает форму, близкую
к сферической; M. несколько увеличивает твёрдость свинца). Как частичный
заменитель сурьмы M. входит в состав нек-рых баббитов и типографских сплавов.
растворимые в воде или могущие перейти в раствор под действием желудочного
сока, чрезвычайно ядовиты; особенно опасен мышьяковистый водород. Из
применяемых на произ-ве соединений M. наиболее токсичен мышьяковистый ангидрид.
Примесь M. содержат почти все сульфидные руды цветных металлов, а также
железный (серный) колчедан. Поэтому при их окислит, обжиге, наряду с сернистым
ангидридом SO
малой эффективности очистных сооружений отходящие газы рудообжигательных
печей увлекают заметные количества As
ядовитого As
соляной к-тами, содержащими примесь M., т. к. при этом образуется мышьяковистый
водород.
M.
повсеместно распространён в живой природе. Cp. содержание M. в почвах 4-10-'%,
в золе растений - 3·10-5%. Содержание M. в мор. организмах выше,
чем в наземных (в рыбах 0,6-4,7 мг в 1 кг сырого вещества, накапливается
в печени). Cp. содержание M. в теле человека 0,08-0,2 мг/кг.
В крови
M. концентрируется в эритроцитах, где он связывается с молекулой гемоглобина
(причём в глобиновой фракции содержится его вдвое больше, чем в геме).
Наибольшее кол-во его (на 1 г ткани) обнаруживается в почках и печени.
Много M. содержится в лёгких и селезёнке, коже и волосах; сравнит, мало
- в спинномозговой жидкости, головном мозге (гл. обр. гипофизе), половых
железах и др. В тканях M. находится в основной белковой фракции, значит,
меньше - в кислоторастворимой и лишь незначительная часть его обнаруживается
в липидной фракции. M. участвует в окислит.-восстановит, реакциях: окислит,
распаде сложных углеводов, брожении, гликолизе и т. п. Соединения M. применяют
в биохимии как специфич. ингибиторы ферментов для изучения реакций
обмена веществ.
M. (аминарсон, миарсенол, новарсенал, осарсол) применяют, гл. обр., для
лечения сифилиса и протозойных заболеваний. Неорганические препараты M.
- натрия арсенит (мышьяково-кислый натрий), калия арсенит (мышья-ковистокислый
калий), мышьяковистый ангидрид As
препараты M. могут вызывать некротизи-рующий эффект без предшествующего
раздражения, отчего этот процесс протекает почти безболезненно; это свойство,
к-рое наиболее выражено у As
лечения псориаза.
M. 74As(T1/2 = 17,5 сут) и 76As(T1/2 = 26,8
ч)
используют
в диаг-ностич. и леч. целях. С их помощью уточняют локализацию опухолей
мозга и определяют степень радикальности их удаления. Радиоактивный M.
используют иногда при болезнях крови и др.
по защите от излучений, предельно допустимое содержание 76As
в организме 11 мккюри. По сан. нормам, принятым в СССР, предельно
допустимые концентрации 76As в воде и открытых водоёмах 1· 10-7кюри/л,
в
воздухе рабочих помещений 5·10-11 кюри/л.
Все препараты
M. очень ядовиты. При остром отравлении ими наблюдаются сильные боли в
животе, понос, поражение почек; возможны коллапс, судороги. При хронич.
отравлении наиболее часты желудочно-кишечные расстройства, катары слизистых
оболочек дыхат. путей (фарингит, ларингит, бронхит), поражения кожи (экзантема,
меланоз, гиперкератоз), нарушения чувствительности; возможно развитие апластич.
анемии. При лечении отравлений препаратами M. наибольшее значение придают
унитиолу (см. Антидоты).
должны быть направлены прежде всего на механизацию, герметизацию и обеспыливание
технологич. процесса, на создание эффективной вентиляции и обеспечение
рабочих средствами индивидуальной защиты от воздействия пыли. Необходимы
регулярные мед. осмотры работающих. Предварительные мед. осмотры производят
при приёме на работу, а для работающих - раз в полгода.
химии, пер. с нем., т. 1, M., 1963, с. 700 - 712; Погодин С. А., Мышьяк,
в кн.: Краткая химическая энциклопедия, т. 3,
под общ. ред. H. В. Лазарева. 6 изд.. ч. 2, Л., 1971.