МУЛЬТИПЛЕТНОСТЬ
(от лат. multiplex
M. определяет кратность вырождения
Значения M. для квантовых состояний
M. А. Елъяшевич.
- многократный), число возможных ориентации в пространстве полного спина
атома
или молекулы. Согласно квантовой механике, M.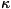
= 2S + 1, где S - спиновое квантовое число. Для систем с нечётным
числом N электронов S = 1/2, 3/2, 5/2,... и M. чётная (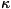
= 2, 4, 6,...). Для них возможны дублетные, квартетные, секстетные и т.
д. квантовые состояния. Если N четно, S = O, 1, 2,... и M. нечётная (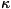
= 1, 3, 5,...) - возможны синглетные, триплетные, квинтетные и т. д. состояния.
Так, для систем с 1 электроном (атом H, ион H
S = 1/2,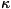 = 2) получаются лишь
= 2) получаются лишь
дублетные состояния; с 2 электронами (атом Не, молекула H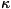
= 1, спины электронов антипараллельны) и триплетные состояния (S=1,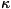
= 3, спины электронов параллельны). Для N электронов макс. M. (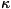
= N + 1) соответствует параллельному направлению их спинов.
уровней атома или молекулы. 2S + 1 квантовых состояний, соответствующих
уровню энергии с заданным S, отличаются значениями проекции полного спина
и характеризуются квантовым числом Ms = S, S-1,...,- S, определяющим величину
этой проекции. Вследствие спин-орбитального взаимодействия уровень
энергии может расщепиться на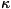
= 2S + 1 подуровней (мультиплетное расщепление, приводящее к расщеплению
спектральных линий, см. Тонкая структура).
атомов и молекул определяются электронами в незамкнутых оболочках, т. к.
в заполненных оболочках спины электронов компенсируются. Для уровней энергии
щелочных металлов с 1 внешним электроном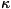
= 2, как и для атома H; для уровней энергии сложных атомов с заполняющимися
р-,
d- и f-оболочками M. могут быть высокими (до 11). Для химически устойчивых
молекул, имеющих, как правило, чётное число электронов, характерны M.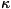
= 1 для основного и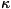 = 1 и 3 для
= 1 и 3 для
возбуждённых уровней энергии; для свободных радикалов с одним электроном
с некомпенсированным спином типична M.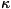
= 2.
А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Ъ Ы Ь Э Ю Я