МОЛЕКУЛА
(новолат. molecula, уменьшит,
от лат. moles - масса), наименьшая частица вещества, обладающая его хим.
свойствами. М. состоит из атомов, точнее - из атомных ядер, окружающих
их внутренних электронов и внешних валентных электронов, образующих хим.
связи (см.Валентность). Внутр. электроны атомов обычно не участвуют
в образовании хим. связей. Состав и строение молекул данного вещества не
зависят от способа его получения. В случае одноатомных молекул (напр.,
инертных газов) понятия М. и атома совпадают.
Впервые понятие о М. было введено в химии
в связи с необходимостью отличать М. как наименьшее количество вещества,
вступающее в хим. реакции, от атома как наименьшего количества данного
элемента, входящего в состав М. (Междунар. конгресс в Карлсруэ, I860).
Осн. закономерности строения М. были установлены в результате исследования
хим. реакций, анализа и синтеза хим. соединений, а также благодаря применению
ряда физ. методов.
Атомы объединяются в М. в большинстве случаев
хим. связями. Как правило, такая связь создаётся одной, двумя или тремя
парами электронов, к-рыми владеют сообща два атома. М. может содержать
положительно и отрицательно заряженные атомы, т. е. ионы; в этом случае
реализуются электростатич. взаимодействия. Помимо указанных, в М. существуют
и более слабые взаимодействия между атомами. Между валентно не связанными
атомами действуют силы отталкивания.
Состав М. выражают формулами химическими.
Развитие учения о структуре молекул неразрывно
В нек-рых случаях изомерные М. быстро превращаются
В физике понятие о М. оказалось необходимым
В твёрдом теле М. могут сохранять или не
Строение молекул. Геометрическая структура
Рис. 1. Зависимость потенциальной энергии
Равновесные межъядерные расстояния г о
между 2 данными валентно связанными атомами
можно приписать каждому атому в данном
Размер М. как целого, т. е. размер её электронной
Ван-дер-ваальсовы радиусы существенно превышают
Рис. 2. Модели структур некоторых простых
Ковалентные хим. связи в М. расположены
Таким образом, многоатомная М. обладает
М., содержащие единичные связи, или сигма-связи,
Взаимодействие атомов в молекуле. Природа
Хим. связи в М. подавляющего числа органич.
Аддитивность энергии М. выполняется не
Совр. квантовомеханич. теория хим. связи
В подавляющем большинстве случаев суммарный
Электрические и оптические свойства молекул.
Оптич. свойства вещества характеризуют
Магнитные свойства молекул. М. и макромолекулы
вость М. (х) в ряде органич. соединений
Парамагнитны М., обладающие постоянным
Атомные ядра элементов, у к-рых атомный
Спектры и строение молекул. Элект-рич.,
Частоты в спектрах, соответствующих вращат.
Общее число линий или полос в колебательном
Электронные переходы в М. характеризуют
Молекулы в химии, физике и биологии. Понятие
Равновесные и кинетич. свойства больших
Развитие биологии, химии и молекулярной
Лит.: С ы р к и н Я. К., Д я т к
М. В. Волъкенштейн.
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
Эмпирич.
формула (напр., С
хим. анализом, и молекулярной массы.
связано с успехами прежде всего органич. химии. Теория строения органич.
соединений, созданная в 60-х гг. 19 в. трудами A.M.. Бутлерова, Ф.
А. Ке-куле, А. С. Купера и др., позволила представить строение
молекул структурными формулами или формулами строения, выражающими последовательность
валентных хим. связей в М. При одной и той же эмпирич. формуле могут существовать
М. разного строения, обладающие различными свойствами (явление изомерии).
Таковы,
напр., этиловый спирт С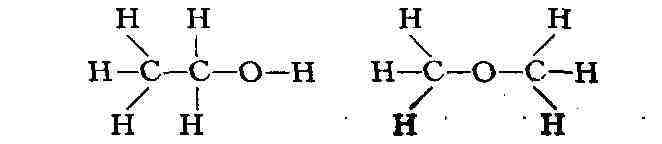
одна в другую и между ними устанавливается динамич. равновесие (см. Таутомерия).
В
дальнейшем Я. X. Вант-Гофф и независимо франц. химик А. Ж. Ле Бель
пришли к пониманию пространственного расположения атомов в молекуле и к
объяснению явления стереоизомерии. А. Вернер (1893) распространил
общие идеи теории строения на неорганич. комплексные соединения. К нач.
20 в. химия располагала подробной теорией строения М., исходящей из изучения
только их хим. свойств. Замечательно, что прямые физ. методы исследования,
развитые позднее, в подавляющем большинстве случаев полностью подтвердили
структурные формулы химии, установленные путём исследования макроскопич.
количеств вещества, а не отдельных М.
для объяснения свойств газов, жидкостей и твёрдых тел. Прямое экспериментальное
доказательство существования М. впервые было получено при изучении броуновского
движения (франц. физик Ж. Перрен, 1906).
сохранять свою индивидуальность. Так, большинство М. органич. соединений
образует молекулярные кристаллы, в узлах решёток к-рых находятся
М., связанные одна с другой относительно слабыми силами межмолекулярного
взаимодействия. Напротив, в ионных (напр., в случае NaCl) и атомных (алмаз)
кристаллах нет отдельных М. и весь кристалл подобен одной М. (см. Кристаллохимия).
Структура
М. может изменяться при переходе от кристалла к газу. Так, N
в кристалле - из ионов NO
PCl4+.
М. определяется равновесным расположением атомных ядер. Энергия взаимодействия
атомов зависит от расстояния между ядрами. На очень больших расстояниях
эта энергия равна нулю; если при сближении атомов образуется хим. связь,
то атомы сильно притягиваются друг к другу (слабое притяжение наблюдается
и без образования хим. связи); при дальнейшем сближении атомов действуют
электростатич. силы отталкивания атомных ядер; препятствием к силь-. ному
сближению атомов является также невозможность совмещения их внутренних
электронных оболочек. На рис. 1 показана зависимость потенциальной энергии
двухатомной М. от межъядерного расстояния r. Эта энергия минимальна
при равновесном расстоянии r
стремится к бесконечности и возрастает до бесконеч. при r стремящ. к 0.
Разность энергий при r
Равновесные расстояния r
рентгеновского
структурного анализа и электронографии, а также нейтронографии,
позволяющими
получить сведения и о распределении электронов (электронной плотности)
в М. Рентгено-графич. изучение молекулярных кристаллов даёт возможность
установить гео-метрич. строение очень сложных М., вплоть до М. белков.
Косвенную, но весьма детальную информацию о строении сложных М. получают
различными спектроскопич. методами, в особенности с помощью спектров ядерного
магнитного резонанса (ЯМР). Геометрия простых М., содержащих малое
число атомов, также эффективно исследуется методами спектроскопии. Расстояния
(в А)
U
двухатомной
молекулы (или отдельной химической связи) от межатомного расстояния г
(га - равновесное расстояние, D - энергия диссоциации, О, 1, 2,...-
уровни энергии колебаний).
и энергии диссоциации D (при 25 °С) некоторых двухатомных молекул
(ккал/молъ)
A
(ккал/моль)
Li
N
О
F
Na
Cl
2,67
1,09
1,21
1,48
3,08
1,99
104,7 (25)
94,3 (22,5)
495,7 (118,3) 155(37)
78,5 (17,3)
242,6 (57,9)
I
LiH
NaH
HF
НС1
HI
2,67
1,59
1,89
0,92
1,27
1,60
147,1 (35,1) 243(58)
196,9 (47)
565,6 (135) 431,6(103)
264 (63)
приблизительно постоянны в М. различных соединений, они уменьшают-ся с
увеличением кратности связи:
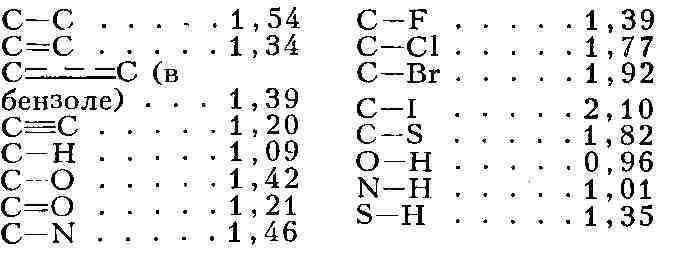
валентном состоянии в М.определён-ный атомный, или ковалентный, радиус
в случае ионной связи - ионный радиус, см. Атомные радиусы, Ионные радиусы),
характеризующий
размеры электронной оболочки атома (иона), образующего хим. связь в М.
Представление о фиблизительном постоянстве этих радиусов оказывается полезным
при оценке межатомных расстояний и, следовательно, при расшифровке структуры
М. Длина связи представляет собой сумму соответствующих атомных радиусов.
оболочки, есть величина до нек-рой степени условная - имеется отличная
от нуля, хотя и весьма малая, вероятность найти электроны М. и на большом
расстоянии от её атомлых ядер. практически размеры М. определяются равновесным
расстоянием, на к-рое они могут быть сближены при плотной упаковке М. в
молекулярном кристалле и в жидкости. На больших расстояниях М. притягиваются
одна к другой, на меньших - отталкиваются. Размеры М. поэтому можно найти
с помощью рентгеноструктурного анализа молекулярных кристаллов, порядок
величины этих размеров может быть определён из коэффициентов диффузии,
теплопроводности и вязкости газов и из плотности вещества в конденсированном
состоянии. Расстояние, на к-рое могут сблизиться валентно нe связанные
атомы, принадлежащие од-ной и той же М. или различным М., мо-жет быть охарактеризовано
средними значениями т. н. ван-дер-ваальсовых радиусов (в А ):
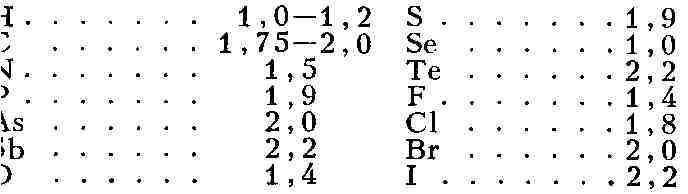
ковалентные. Зная вели-чины ван-дер-ваальсовых, ковалентных, атакже ионных
радиусов, можно постро-ить наглядные модели М., отражающие форму и размеры
их электронных оболо-чек (рис. 2).
молекул (радиусы сфер - вандер-ваальсовы).
под определёнными углами, зависящими от состояния гибридизации атом-ных
орбиталей (см. Валентность). Так, для М. насыщенных органич. соединений
характерно тетраэдрич. расположение связей, образуемых атомом углерода;
для М. с двойной связью (С = С) - плоское расположение связей атомов углерода;
в М. соединений с тройной связью (С = С)-линейное расположение связей:
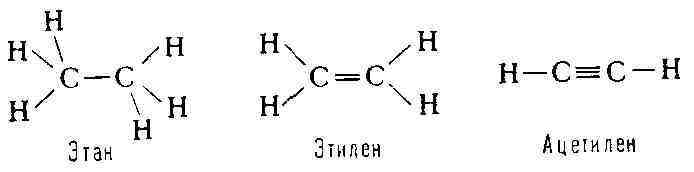
определённой конфигурацией в пространстве, т. е. определённой геометрией
расположения связей, к-рая не может быть изменена без их разрыва. М. характеризуется
той или иной симметрией расположения атомов. Если М. не имеет плоскости
и центра симметрии, то она может существовать в двух конфигурациях, представляющих
зеркальные отражения одна другой (зеркальные антиподы, или стереоизомеры,
см. Изомерия). Все важнейшие биологически функциональные вещества
в живой природе фигурируют в форме одного определённого стереоизомера.
могут существовать в различных конформациях, возникающих при поворотах
атомных групп вокруг единичных связей. Важные особенности макромолекул
синтетич. и биологич. полимеров определяются именно их кон-формационными
свойствами.
хим. связей в М. оставалась загадочной вплоть до создания квантовой механики
- классич. физика не могла объяснить насыщаемость и направленность валентных
связей. Основы теории хим. связи были созданы В. Гейтлером и нем.
учёным Ф. Лондоном в 1927 на примере простейшей молекулы Н
в частности на основе широкого применения молекулярных орбиталей метода,
и
квантовая
химия позволяет вычислять межатомные расстояния, энергии М., энергии
хим. связей и распределение электронной плотности для сложных М.; при этом
расчётные данные хорошо согласуются с экспериментальными.
соединений являются кова-лентными. Напротив, в ряде неорганич. соединений
существуют ионные, а также донорно-акцепторные связи (см. Химическая
связь), реализуемые в результате обобществления неподелённой пары электронов
данного атома. Энергия образования М. из атомов во мн. рядах сходных соединений
приближённо аддитивна. Иными словами, в этих случаях можно считать, что
энергия М. есть сумма энергий её связей, имеющих постоянные значения в
рассматриваемом ряду. Отсюда следует практич. возможность приписать хим.
связям приближённо автономные электронные оболочки.
всегда. Яркий пример нарушения аддитивности представляют плоские М. органич.
соединений с т. н. сопряжёнными связями, т. е. с кратными связями, чередующимися
с единичными. В этих случаях валентные электроны, определяющие кратность
связей, т. н. я-электроны, становятся общими для всей системы сопряжённых
связей, делокализованными. Такая делокализация электронов приводит к дополнительной
стабилизации М. Напр., энергия образования М. 1,3-бутадиена Н
(на
4 ккал/моль). Выравнивание электронной плотности вследствие обобществления
л-электронов по связям выражается в удлинении двойных связей и укорочении
единичных. В правильном шестиугольнике межуглеродных связей бензола (см.
формулу) все связи одинаковы и имеют длину, промежуточную между длиной
единичной и двойной связи. Сопряжение связей ярко проявляется в молекулярных
спектрах (см. ниже).
учитывает частичную делокали-зацию не только я-, но и а-электронов, наблюдающуюся
в любых молекулах. Вообще говоря, это не нарушает аддитивности энергий
молекул.
спин валентных электронов в М. равен нулю, т. е. спины электронов попарно
насыщены. М., содержащие неспаренные электроны - радикалы свободные
(напр.,
атомный водород Н', метил СН'з), обычно неустойчивы, т. к. при их соединении
друг с другом происходит значит, понижение энергии вследствие образования
валентных связей. Наиболее эффективным методом изучения строения свободных
радикалов является электронный парамагнитный резонанс (ЭПР).
Поведение вещества в электрич. поле определяется основными электрич. характеристиками
М.- постоянным ди-польным моментом и поляризуемостью. Дипольный
момент означает несовпадение центров тяжести положит, и от-рицат. зарядов
в М., т. е. электрич. асимметрию М. Соответственно М., имеющие центр симметрии,
напр. Н
ед. СГС). Поляризуемостью характеризуется способность электронной оболочки
любой М. смещаться под действием электрич. поля, в результате чего в М.
создаётся индуцированный дипольный момент. Значения дипольного момента
и поляризуемости находят экспериментально с помощью измерений диэлектрической
проницаемости. В случае аддитивности свойств М. дипольный момент М.
может быть представлен суммой дипольных моментов связей (с учётом их направления),
то же относится к поляризуемости М.
его поведение в переменном электрич. поле световой волны - тем самым они
определяются поляризуемостью М. вещества. С поляризуемостью непосредственно
связаны преломление и рассеяние света, оптическая активность и др.
явления, изучаемые молекулярной оптикой - разделом физич. оптики,
посвящённым изучению оптич. свойств вещества.
подавляющего большинства хим. соединений диамагнитны (см. Диамагнетизм).
Магнитная восприимчи-
может быть выражена как сумма значений х Для отдельных связей;
однако аддитивность х выполняется хуже, чем аддитивность поляризуемостей
а. И х, и а определяются свойствами внешних электронов М.; эти две величины
связаны одна с другой.
магнитным моментом (см. Парамагнетизм). Таковы М. с нечётным числом
электронов во внешней оболочке (напр., NO и любые свободные радикалы),
М., содержащие атомы с незамкнутыми (незаполненными) внутр. оболочками
(переходные металлы и др.). Магнитная восприимчивость парамагнитных веществ
зависит от темп-ры, т. к. тепловое движение препятствует ориентации магнитных
моментов в магнитном поле. Строение парамагнитных М. эффективно изучается
методом ЭПР.
номер или массовое число нечётны, обладают ядерным спиновым парамагнетизмом.
Для таких ядер характерен ядерный магнитный резонанс (ЯМР), спектр к-рого
зависит от электронного окружения ядер в М. Поэтому спектры ЯМР служат
источником очень подробной информации о строении М., в т. ч. и весьма сложных,
напр, белков (см. также Ядерный квадруполъный резонанс, Магнетизм, Магнетохимия).
оптич., магнитные и др. свойства М. в конечном счёте связаны с волновыми
функциями и энергиями различных состояний М.; через них выражаются
и электрич. дипольный момент, и магнитный момент, и поляризуемость, и магнитная
восприимчивость. Прямую информацию о состояниях М. и вероятностях перехода
между ними дают молекулярные спектры.
переходам, зависят от моментов инерции М., определение к-рых из спект-роскопич.
данных позволяет получить наиболее точные значения межатомных расстояний
в М.
спектре М. зависит от её симметрии. Частоты колебаний, наблюдаемые в спектрах,
определяются, с одной стороны, массами атомов и их расположением, с другой
- динамикой межатомных взаимодействий. Теория колебаний многоатомных М.
соответственно опирается на теорию хим. строения и классическую механику
связанных колебаний. Исследование колебательных спектров позволяет сделать
ряд выводов о строении М., о межатомных и межмолекулярных взаимодействиях,
изучать явления таутомерии, поворотной изомерии.
структуру их электронных оболочек, состояние хим. связей. Спектры М., обладающих
большим числом сопряжённых связей, характеризуются длинноволновыми полосами
поглощения, попадающими в видимую область. Вещества, построенные из таких
М., обладают цветностью, к ним относятся все органич. красители. Изучение
электронно-колебательных спектров М. необходимо для понимания естественной
и магнитной оптич. активности.
о М.- основное для химии, и большей частью сведений о строении и функциональности
М. наука обязана хим. исследованиям. При хим. реакции происходит превращение
одних М. в другие. Для такого превращения обычно необходима нек-рая избыточная
энергия М.-энергия активации (см. Кинетика химическая). В акте хим.
взаимодействия М. проходят через конфигурацию т. н. активированного комплекса,
или переходного состояния М. Характер и скорость хим. реакции определяются
этим состоянием, в свою очередь зависящим от строения взаимодействующих
М. Химия решает две главные задачи, относящиеся к М.,-устанавливает строение
М. на основании хим. реакций и, наоборот, на основе строения М. определяет
ход реакций. Широкая совокупность важнейших проблем совр. химии, в т. ч.
и нерешённых, сводится к теории хим. реакционной способности. Исследование
этих проблем требует применения как теоретич. методов квантовой химии,
так и экспериментальных данных, получаемых хим. и физ. методами. Физ. явления,
определяемые строением и свойствами М., изучаются молекулярной физикой.
Термодинамич.
свойства любого вещества, построенного из М., в конечном счёте выражаются
через значения энергий всех возможных состояний М., находимых из спектроскопич.
данных. Строение М. и межмолекулярные взаимодействия ответственны за равновесные
свойства вещества. То же относится к неравновесным, кинетич., свойствам.
Установление равновесия требует нек-рого времени - времени релаксации.
При
быстрых изменениях состояния вещества равновесие может не успеть установиться.
Эти явления наблюдаются, напр., при прохождении ультразвука через вещество
и сказываются на поглощении и дисперсии звуковых волн (см.
Молекулярная
акустика). Равновесие устанавливается в результате взаимодействия М.
при их соударениях в газе и жидкости, в результате поглощения и излучения
света и т. д. Время релаксации М. в конденсированной среде существенно
зависит от темп-ры, с ростом к-рой увеличивается подвижность М. В ряде
случаев М. в жидкости практически утрачивают свою подвижность ещё до кристаллизации:
происходит стеклование вещества. Подвижностью М. определяются способность
веществ к диффузии, их вязкость, теплопроводность
и т. д.
Непосредств. изучение подвижности М., определение времён релаксации проводятся
методами поглощения и дисперсии электромагнитных волн, ЯМР, ЭПР и др. способами.
цепных М., образующих полимеры (см. Макромолекула), специфичны.
Особенности поведения макромолекул определяются прежде всего их гибкостью
-способностью находиться в большом числе различных конформаций, возникающих
в результате поворотов вокруг единичных связей.
физики привело к построению молекулярной биологии, исследующей осн.
явления жизни, исходя из строения и свойств биологически функциональных
М. Организм существует на основе тонко сбалансированных химических и нехимических
взаимодействий между М. Таким образом, изучение строения и свойств М. имеет
фундаментальное значение для естествознания в целом.
и н а М. Е., Химическая связь и строение молекул, М.-Л., 1946; Паулин г
Л., Природа химической связи, пер.
с англ. М.-Л., 1947; Волькенштейн М. В. Строение
и физические свойства молекул М.- Л.,
1955; е г о же, Молекулы и жизнь М., 1965; его
же, Перекрёстки науки, М. 1972; Кондратьев
В. Н., Структура атомов и молекул, 2 изд.,
М., 1959; К о з м а н У., Введение
в квантовую химию, пер. с англ., М., 1960;
С л э т е р Дж., Электронная
структура молекул, пер.
с англ., М., 1965.