МИХАЭЛИСА КОНСТАНТА
один из важнейших
параметров кинетики ферментативных реакций, введённый нем. учёными Л. Михаэлисом
(L. Michaelis) и М. Ментенв 1913; характеризует зависимость скорости ферментативного
процесса от концентрации субстрата. Согласно теории Михаэлиса-Ментен, первым
этапом любого ферментативного процесса является обратимая реакция между
ферментом (Е) и субстратом (S), приводящая к образованию промежуточного
фермент-субстратного комплекса (ES), к-рый затем подвергается практически
необратимому расщеплению на продукт реакции (Р) и исходный фермент:
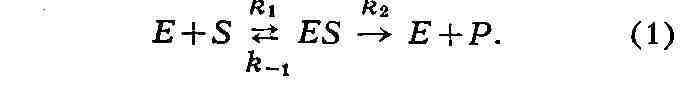
Реакции образования и распада комплекса
ES
характеризуются
константами скорости ki, k-i, k
значительно превышает концентрацию фермента ([S]>>[Е]) и, следовательно,
концентрация ES становится постоянной, скорость ферментативной реакции
(v) выражается уравнением:
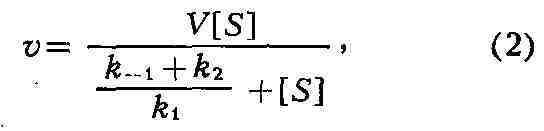
где V - максимальная скорость реакции,
достигаемая при полном насыщении фермента субстратом. Соотношение кон-
![]()
константой (Km), получившей назв.
М. к. Подставляя в уравнение (2) М. к., получаем уравнение Михаэлиса -
Ментен:

Зависимость скорости ферментативной реакции
(и) от концентрации субстрата [S].
Из уравнения (3) следует, что М. к. численно
и может служить мерой сродства субстрата
Лит.:Яковлев В. А., Кинетика ферментативного
равна концентрация субстрата, при к-рой скорость реакции составляет половину
макс, возможной (см. рис.). В ряде случаев, когда величина &![]()
к ферменту. М. к. имеет размерность концентрации. Практически величину
М. к. находят различными гра-фич. методами, исследуя зависимость скорости
ферментативной реакции от концентрации субстрата. См. также Ферментативный
катализ.
катализа, М., 1965; У э б б Л., Ингибиторы ферментов и метаболизма, пер.
с англ., М., 1966. Д. М. Беленький.
А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Ъ Ы Ь Э Ю Я