МЕЗОМЕРИЯ
(отмезо ... и греч.
meros-часть), сопряжение, резонансе сопряжённых системах, характер распределения
электронной плотности в молекулах, к-рый можно трактовать как частичную
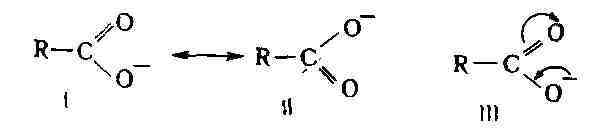
делокализацию связей и зарядов атомов. Так, в карбоксилат-анио-не, согласно
классич. структуре, один из атомов кислорода связан с атомом углерода простой
связью и несёт полный отрицат. заряд, другой соединён двойной связью и
нейтрален. Такая структура может быть выражена двумя равноценными формулами
I и II (см. ниже). Опыт же показывает, что оба атома кислорода равноценны,
т. е. каждый из них несёт один и тот же частичный отрицат. заряд,
а обе связи с атомом С имеют одинаковую
длину. Т. о., истинная структура является промежуточной между I и II; она
может быть изображена как резонансный гибрид канонич. (крайних) структур
I и II (см. Резонанса теория) или мезомерной формулой III, в к-рой изогнутые
стрелки показывают направление смещения электронов, приводящего к выравниванию
зарядов и связей:
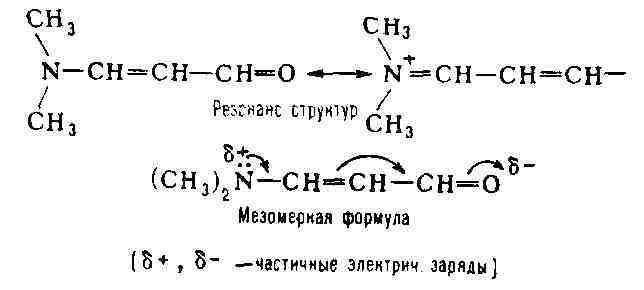
М. ярко проявляется в сопряжённых системах
(см. Сопряжение связей). Обычно она выражает состояние, промежуточное между
классич. структурой и структурой (или структурами) с полностью разделёнными
зарядами, напр.:
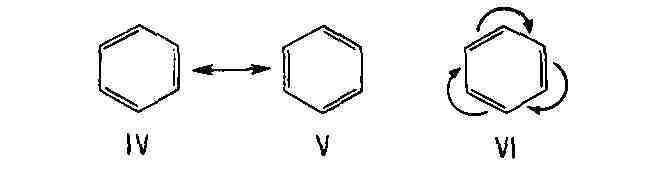
В циклич. сопряжённых системах мезомерное
смещение не всегда приводит к разделению зарядов. Так, строение бензола
может быть представлено как резонансный гибрид двух классич. структур Кекуле
(IV и V) или же мезомерной формулой VI, отражающей равноценность всех шести
атомов углерода и всех связей между ними:
Мезомерный эффект с небольшим ослабеванием
Представление о М. позволяет объяснить
Лит.: Несмеянов А. Н., Несмеянов
передаётся по системе сопряжённых связей (поэтому он наз. также эффектом
сопряжения). Группы, несущие неподелённую электронную пару (R2N-,
RO-, НО-, галогены), обладают положит, мезомерным эффектом (+ М-эффект)
и могут увеличивать электронную плотность остальной части систе-
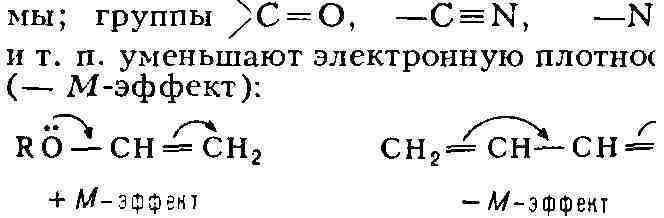
многие свойства веществ и механизмы реакций в органич. химии. Количеств,
картина распределения электронной плотности в молекулах может быть получена
путём квантово-механич. расчётов (см. Квантовая химия).
Концепция М. разработана главным образом
английским химиком К. Инголдом в 1926.
Н. А., Начала органической химии, кн. 1, М., 1969. Б.Л.Дяткин.
А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Ъ Ы Ь Э Ю Я