КРИСТАЛЛОХИМИЯ
изучает пространственное
расположение и химическую связь атомов в кристаллах, а также зависимость
физич. и химич. свойств кристаллич. веществ от их строения. Будучи разделом
химии, К. тесно связана с кристаллографией. Источником экспериментальных
данных о кристаллич. структурах являются гл. обр. рентгенострук-турный
анализ, структурная электронография и нейтронография, с
помощью к-рых определяют абс. величины межатомных расстояний и углы между
линиями химич. связей (валентные углы). К. располагает обширным материалом
о кристаллич. структурах нескольких тысяч химич. веществ, включая такие
сложные объекты, как белки и вирусы.
Осн. задачи К.: систематика кристаллич.
структур и описание наблюдающихся в них типов химич. связи; интерпретация
кристаллич. структур (выяснение причин, определяющих строение того или
иного кристаллич. вещества) и их предсказание; изучение связи физич. и
химич. свойств кристаллов с их структурой и характером химич. связи.
Строение кристаллов обнаруживает исключит.
Кристаллич. структуры в К. делят на
представлять собой конечные группировки
Слоистую структуру имеют графит, BN,
По характеру связи между атомами (в
Различают: ковалентные (напр., iC,
Значения энергии структурыН для
ккал/молъ* Na CH 1 ккал/моль=4,19 кдж/моль.
Уменьшение Н соответствует уменьшению
Кристаллохимич. анализ строения вещества
В области исследований зависимости
Лит.: Белов Н. В., Структура
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
разнообразие; будучи, напр., довольно простым в случае алмаза, оно
оказывается весьма причудливым и сложным в случае кристаллич. бора. Как
правило, каждому кристаллич. веществу присуща своя структура. Однако достаточно
часто (напр., NaCl и КС1, Вr
т-в а). Такие вещества нередко образуют смешанные кристаллы (см. Изоморфизм).
С
др. стороны, одно и то же химич. вещество, будучи полученным при разных
условиях, может иметь разное строение (полиморфизм).
гомодесмические (координационные) и гетеродесмиче-с к и е. В первых все
атомы объединены одинаковыми химич. связями, образующими пространственный
каркас. Здесь нет группировок, к-рые можно было бы назвать молекулами.
Гомодесмическую структуру имеют, напр., алмаз, галоге-ниды щелочных металлов.
Однако гораздо чаще кристаллич. вещества имеют гетеродесмическую структуру;
её характерная черта - присутствие структурных фрагментов, внутри к-рых
атомы соединены наиболее прочными (обычно ковалент-ными) связями. Эти фрагменты
могут
атомов, цепи, слои, каркасы. Соответственно выделяются островные, цепочечные,
слоистые и каркасные структуры. Островными структурами обладают почти все
органич. соединения и такие неорганич. вещества, как галогены, О
"островов" выступают многоатомные ионы (напр., сульфаты, нитраты, карбонаты).
Цепочечное строение имеют, напр., кристаллы одной из модификаций Se (атомы
связаны в бесконечные спирали) или кристаллы PdCl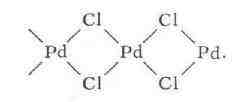
MoS
к-рого расположены атомы Са). Известны гетеродесми-ческие структуры, где
имеются структурные фрагменты разного типа. Так, кристаллы комплексного
соединения [N(CH
случае гомодесмических структур) или между структурными фрагментами (в
случае гетеродесмических структур)
алмаз), ионные (см. Ионные кристаллы), металлические (металлы и
интерметаллические соединения) и молекулярные кристаллы. Кристаллы последней
группы, в к-рой структурные фрагменты связаны межмолекулярным взаимодействием,
имеют наибольшее число представителей. Сюда, в частности, входят кристаллы
инертных газов. Деление кристаллов на указанные группы в значительной мере
условно, поскольку существуют постепенные переходы от одной группы к другой.
Однако типичные представители разных групп существенно различаются по свойствам,
в частности, по величине энергии структуры (работы, необходимой для разъединения
одного моля кристаллич. вещества, взятого при атм. давлении и комнатной
темп-ре, на отд. атомы, ионы или молекулы).
некоторых кристаллов с различными типамихимической связи
прочности связи. Резкое различие величины Н для Fe и Na объясняется
тем,
что в первом случае существ. вклад
даёт ковалентное взаимодействие.
имеет два аспекта: стереохимиче-ский и кристаллоструктурный. В рамках первого
обсуждаются величины кратчайших межатомных расстояний и значения валентных
углов. При этом пользуются понятиями координационного числа (число
ближайших соседей данного атома) и координационного многогранника. Для
атомов мн. элементов, склонных к кова-лентному характеру связи, типичны
определённые координационные числа и координационные многогранники, что
обусловлено направленностью ковалентных связей. Так, атом Be, за редким
исключением, имеет координационное число 4 (тетраэдр); для атома Cd характерно
наличие шести ближайших соседей, расположенных по октаэдру; для двухвалентного
Pd - четырёх, занимающих вершины квадрата (напр., в структуре PdCl
механики (см. Квантовая химия). Кристаллоструктурный аспект включает
в себя исследование относительного расположения фрагментов структуры (
и одноатомных ионов) в пространстве кристаллич. вещества. В случае молекулярных
кристаллов исследуется укладка молекул. Причины образования той или иной
кристаллич. структуры определяются общим принципом термодинамики: наиболее
устойчива структура, к-рая при данном давлении и данной темп-ре имеет минимальную
свободную энергию. Приближённые расчёты свободной энергии и предсказание
наиболее выгодной структуры возможны пока лишь для сравнительно простых
случаев, причём точность расчёта значительно ниже точности эксперимента.
свойств кристаллов от их строения К. перекрывается с кристаллофизикой
и
физикой твёрдого тела.
ионных кристаллов и металлических фаз, [М.], 1947; Б о к и и Г. Б., Кристаллохимия,
3 изд., М., 1971; Китайгородский А. И., Органическая кристаллохимия, М.,
1955; Киттель Ч., Введение в физику твердого тела, пер. с англ., 2 изд..
М., 1962; О р м о н т Б. Ф., Введение в физическую химию и кристаллохимию
полупроводников, М., 1968; К р е б с Г., Основы кристаллохимии неорганических
соединений, пер. с нем., М., 1971. П. М. Зоркий.