КРЕМНИЙ
(лат. Silicium), Si,
хим. элемент IV группы периодич. системы Менделеева; ат. н. 14, ат. м.
28,086. В природе элемент представлен тремя стабильными изотопами: 28Si
(92,27%), 29Si (4,68%) и 30Si (3,05%).
Историч. справка. Соединения К., широко
Распространённость в природе. По распространённости
При магматич. процессах происходит
Физические и химические свойства. К.
К.- полупроводник, находящий всё большее
Полупроводниковый К. с проводимостью
В соответствии с положением К. в периодич.
В соединениях К. (аналогично углероду)
Хим. связь атома К. с другими атомами
К. образует соединения почти со всеми
Получение и применение. К. технич.
Чистый полупроводниковый К. получают
Специально легированный К. широко применяется
К. имеет разнообразные и всё расширяющиеся
Кремний в организме находится в виде
Лит.: Бережной А. С., Кремний
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
распространённые на земле, были известны человеку с каменного века. Использование
кам. орудий для труда и охоты продолжалось неск. тысячелетий. Применение
соединений К., связанное с их переработкой,- изготовление стекла - началось
ок. 3000 лет до н. э. (в Древнем Египте). Раньше других известное соединение
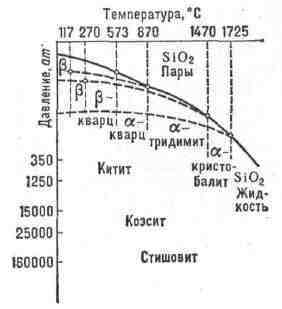
К.- двуокись SiO
состава кремнезёма установил И. Я. Берцелиус. Он же впервые, в 1825,
получил элементарный К. из фтористого кремния SiF
(от лат. silex - кремень). Русское назв. ввёл Г. И. Тесс в 1834.
в земной коре К.- второй (после кислорода) элемент, его среднее содержание
в литосфере 29,5% (по массе). В земной коре К. играет такую же первостепенную
роль, как углерод в животном и растительном мире. Для геохимии К. важна
исключительно прочная связь его с кислородом. Ок. 12% литосферы составляет
кремнезём SiO
75% литосферы слагают различные силикаты и алюмосиликаты (полевые
шпаты, слюды, амфиболы и т. д.). Общее число минералов, содержащих кремнезём,
превышает 400 (см. Кремнезёма минералы).
слабая дифференциация К.: он накапливается как в гранитоидах (32,3%), так
и в ультраосновных породах (19%). При высоких темп-pax и большом давлении
растворимость SiO
концентрации кварца, с которым нередко связаны и рудные элементы (золото-кварцевые,
кварцево-касситеритовые и др. жилы).
образует тёмно-серые с металлич. блеском кристаллы, имеющие кубич. гранецентрированную
решётку типа алмаза с периодом а = 5.431А, плотностью 2,33
г/см3.
При очень высоких давлениях получена новая (по-видимому, гексагональная)
модификация с плотностью 2,55 г/см3. К. плавится при
1417 °С, кипит при 2600 °С. Уд. теплоёмкость (при 20 - 100 °С) 800 дж/(кг
самых чистых образцов не постоянна и находится в пределах (25 °С) 84-126
вт/(м
Температурный
коэфф. линейного расширения 2,33*10-6 К-1, ниже 120К
становится отрицательным. К. прозрачен для длинноволновых ИК-лучей; показатель
преломления (для y = 6 мкм) 3,42; диэлект-рич. проницаемость 11,7.
К. диамагнитен, атомная магнитная восприимчивость -0,13-10-6.
Твёрдость К. по Моосу 7,0, по Бринеллю 2,4 Гн/м2 (240
кгс/мм2),
модуль упругости 109Гн/м2 (10 890
кгс/мм2),
коэфф. сжимаемости 0,325*10-6см2/кг.
К.
хрупкий материал; заметная пластич. деформация начинается при темп-ре выше
800 °С.
применение. Электрич. свойства К. очень сильно зависят от примесей. Собственное
удельное объёмное электросопротивление К. при комнатной температуре принимается
равным 2,3-103 ом*м (2,3-105 ом*см).
р-типа (добавки В, Al, In или Ga) и га-типа (добавки Р, Bi, As или Sb)
имеет значительно меньшее сопротивление. Ширина запрещённой зоны по электрич.
измерениям составляет 1,21 эв при О К и снижается до 1,119 эв
при
300 К.
системе Менделеева 14 электронов атома К. распределены по трём оболочкам:
в первой (от ядра) 2 электрона, во второй 8, в третьей (валентной) 4; конфигурация
электронной оболочки 1s22s22p63s23p2
(см. Атом). Последовательные потенциалы ионизации (эв): 8,149; 16,34;
33,46 и 45,13. Атомный радиус 1,ЗЗА, ковалентный радиус 1Д7А, ионные радиусы
Si4+0,39A, Si4- 1,98А.
4-валентен. Однако, в отличие от углерода, К. наряду с координац. числом
4 проявляет координац. число 6, что объясняется большим объёмом его атома
(примером таких соединений являются кремнефториды, содержащие группу [SiF
осуществляется обычно за счёт гибридных sр3-орбиталей, но возможно
также вовлечение двух из его пяти (вакантных) 3d-орбиталей, особенно
когда К. является шестикоординационным. Обладая малой величиной электроотрицательности,
равной 1,8 (против 2,5 у углерода; 3,0 у азота и т. д.), К. в соединениях
с неметаллами электроположителен, и эти соединения носят полярный характер.
Большая энергия связи с кислородом Si - О, равная 464 кдж/молъ (111
ккал/молъ),
обусловливает стойкость его кислородных соединений (SiO
в отличие от углерода, для К. не характерно образование длинных цепей
и двойной связи между атомами Si. На воздухе К. благодаря образованию защитной
окисной плёнки устойчив даже при повышенных темп-pax. В кислороде окисляется
начиная с 400 °С, образуя кремния двуокись SiO
резкого охлаждения может быть получен твёрдый продукт, легко разлагающийся
на тонкую смесь Si и SiO
в горячих растворах щелочей с выделением водорода. К. реагирует с фтором
при комнатной темп-ре, с остальными галогенами - при нагревании с образованием
соединений общей формулы SiX
непосредственно не реагирует с К., и кремневодороды (силаны) получают
разложением силицидов (см. ниже). Известны кремневодороды от SiH
С азотом К. реагирует при темп-ре выше 1000 оС, Важное практич.
значение имеет нитрид Si
а также к расплавл. металлам и шлакам, что делает его ценным материалом
для химической пром-сти, для производства огнеупоров и др. Высокой твёрдостью,
а также тер-мич. и хим. стойкостью отличаются соединения К. с углеродом
(кремния
карбид SiC) и с бором (SiB
меди) с хлорорганич. соединениями (напр., с СНзСl) с образованием органогалосила-нов
[напр., Si(СН
металлами - силициды (не обнаружены соединения только с Bi, Tl,
Pb, Hg). Получено более 250 силицидов, состав к-рых (MeSi, MeSi
и твёрдостью; наибольшее практич. значение имеют ферросилиций (восстановитель
при выплавке специальных сплавов, см. Ферросплавы) и силицид молибдена
MoSi
чистоты (95-98%) получают в электрич. дуге восстановлением кремнезёма SiO
разработаны методы получения чистого и особо чистого К. Это требует предварительного
синтеза чистейших исходных соединений К., из к-рых К. извлекают путём восстановления
или термич. разложения.
в двух видах: прликристалличе-ский (восстановлением SiCl
из расплавл. К.- метод Чохральского).
как материал для изготовления полупроводниковых приборов (транзисторы,
термисторы, силовые выпрямители тока, управляемые диоды - тири-сторы; солнечные
фотоэлементы, используемые в космических кораблях, и т. д.). Поскольку
К. прозрачен для лучей с длиной волны от 1 до 9 мкм, его применяют
в инфракрасной оптике (см. также Кварц),
области применения. В металлургии К. используется для удаления растворённого
в расплавл. металлах кислорода (раскисления). К. является составной частью
большого числа сплавов железа и цветных металлов. Обычно К. придаёт сплавам
повышенную устойчивость к коррозии, улучшает их литейные свойства и повышает
механич. прочность; однако при большем его содержании К. може вызвать хрупкость.
Наибольшее значение имеют железные, медные и алюминиевые сплавы, содержащие
К. Всё большее количество К. идёт на синтез кремнийорганич. соединений
и силицидов. Кремнезём и многие силикаты (глины, полевые шпаты, слюды,
тальки и т. д.) перерабатываются стекольной, цем., керамич., электротехнич.
и др. отраслями пром-сти. В. П. Барзаковский.
различных соединений, участвующих гл. обр. в образовании твёрдых скелетных
частей и тканей. Особенно много К. могут накапливать нек-рые мор. растения
(напр., диатомовые водоросли) и животные (напр., крем-нероговые губки,
радиолярии), образующие при отмирании на дне океана мощные отложения двуокиси
кремния. В холодных морях и озёрах преобладают биогенные илы, обогащённые
К., в тропич. морях - известковые илы с низким содержанием К. Среди наземных
растений много К. накапливают злаки, осоки, пальмы, хвощи. У позвоночных
животных содержание двуокиси кремния в зольных веществах 0,1-0,5%. В наибольших
кол-вах К. обнаружен в плотной соединит. ткани, почках, поджелудочной железе.
В суточном рационе человека содержится до 1 г К. При высоком содержании
в воздухе пыли двуокиси кремния она попадает в лёгкие человека и вызывает
заболевание - силикоз. В. В. Ковальский.
и его бинарные системы. К., 1958; Красюк Б. А., Грибов А. И.. Полупроводники
- германий и кремний, М., 1961; Реньян В. Р., Технология полупроводникового
кремния, пер. с англ., М.. 1969; Салли И. В., Фалькевич Э. С., Производство
полупроводникового кремния, М., 1970; Кремний и германий. Сб. ст., под
ред. Э. С. Фалькевича, Д. И. Левинзона, в. 1 - 2, М., 1969 - 70; Гладышевский
Е. И., Кристаллохимия силицидов и германидов, М., 1971; Wolf Н. F.. Silicon
semiconductor data, Oxf.- N. Y., 1965.