КИСЛОТЫ И ОСНОВАНИЯ
классы
в разбавленных растворах, наз. сильными.
Определение понятий К. и о. на основе
где ВРз - кислота, a NH Как брёнстедовские, так и льюисовские
Многообразные - структурные и динамические
Лит.: Людер В., Цуффанти С.,
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
хим. соединений. Обычно кислотами наз. вещества, содержащие водород (НС1,
HNO
и
диссоциирующие в воде с образованием ионов Н+ (точнее, ионов
гидроксония Н
характерный острый вкус водных растворов кислот, а также их способность
изменять окраску индикаторов химических. По числу отщепляющихся
протонов различают кислоты одноосновные (напр., азотная НЫОз, соляная НС1,
уксусная СНзСООН), двухосновные (серная H
Чем больше ионов гидроксония присутствует в водном растворе кислоты, т.
е. чем выше степень диссоциации последней, тем кислота сильнее. Кислоты,
полностью диссоциированные
К слабым относятся кислоты с константой ионизации (характеризующей степень
диссоциации кислоты в растворе, напр., при 25 °С) ниже 10-5
(уксусная
1.8-10-5, синильная 7,9-10-10). Диссоциация
многоосновных кислот происходит в неск. ступеней, каждая из к-рых имеет
свою константу ионизации. Напр., константа ионизации Н
на Н+ и РО
к-тах см. также Карболовые кислоты. Основаниями обычно наз. вещества,
содержащие гидроксильную группу ОН [КОН, NaOH, Са(ОН)
ионов ОН-. Большинство оснований нерастворимо в воде. Растворимые в воде
основания наз. щелочами. Присутствием ионов ОН- и объясняется характерный
щелочной вкус растворов щелочей, а также их способность изменять окраску
индикаторов. Основания с 1, 2, 3 гидроксильными группами наз. соответственно
одно-, двух-, трёхкислотными. Не полностью диссоциирующие при растворении
в воде основания наз., как и кислоты, слабыми. К сильным основаниям относятся
гидроокиси калия КОН, натрия NaOH, бария Ва(ОН)2. О принципах установления
названий К. и о. см. Номенклатура неорганических соединений. Понятия
К. и о. возникли ещё на заре развития химии. В 1778 франц. химик А. Л.
Лавуазье попытался объяснить особенности свойств кислот содержанием кислорода.
Несостоятельность такого мнения стала очевидной, когда оказалось, что мн.
кислородсодержащие вещества (окислы металлов, щёлочи, соли и др.) не
проявляют кислотных свойств, а ряд типичных кислот (соляная, синильная,
плавиковая и др.), как показали англ, учёный Г. Дэви (1810) и
франц. учёный Ж. Л. Гей-Люссак (1814), не содержат кислорода. Швед, химик
И. Я. Берцелиус (1812-19) видел причину кислотных и основных свойств
в электрич. природе окислов: электроотрицательные окислы неметаллов (и
нек-рых металлов-хрома, марганца) он считал кислотами, а электроположительные
окислы металлов - основаниями. В 1814 Г. Дэви предложил признать носителем
кислотных свойств водород, входящий в состав всех известных тогда соединений,
обладающих кислотными свойствами, а нем. химик Ю. Либих (1833) внёс
существенное уточнение, что кислотные свойства вещества обусловлены не
всеми содержащимися в нём атомами водорода, а лишь теми из них, к-рые могут
замещаться металлом с образованием солей. После появления (1884-87)
теории
электролитической
диссоциации швед, учёного С. Аррениуса кислотами стали наз. соединения,
при диссоциации к-рых в водном растворе образуются ионы водорода Н+,
а основаниями - соединения, диссоциирующие с отщеплением иона гидроксила
ОН-. По мере развития теории растворов
стало ясно, что важную роль
в процессе электролитич. диссоциации веществ играет взаимодействие как
самих веществ, так и продуктов их диссоциации с растворителем. Было выяснено
также, что ион Н+ не может находиться в растворе в свободном
виде: вследствие очень высокой плотности заряда он прочно соединяется с
молекулами растворителя (сольватируется) и реально существует в
виде сольватного иона, в водных растворах - иона гидроксония, к-рый и является
носителем кислотных свойств.
теории электролитич. диссоциации часто вполне достаточно для практич. целей.
Однако, как было установлено уже давно, мн. соединения, проявляющие типичные
свойства К. и о., не содержат ни водорода, ни групп ОН. Кроме того, одно
и то же вещество нередко в одних реакциях ведёт себя как кислота, а в других
- как основание (см. Амфотерностъ). Способность вещества реагировать
как кислота или основание является, т. о., не абсолютным свойством этого
вещества, а выражается в конкретных хим. реакциях, относимых к классу кислотноосновных.
В таких реакциях одно из взаимодействующих веществ играет роль кислоты
по отношению к др. веществу, играющему роль основания. Итак, способность
вещества реагировать в качестве кислоты или основания является его функциональной
характеристикой. Было предпринято множество попыток разработать единую
теорию, к-рая позволила бы, с учётом указанных обстоятельств, однозначно
относить данное вещество к классу кислот или оснований. Однако до сих пор
единого критерия для этсго не найдено. Наиболее распространены две концепции
- дат. физико-химика И. Н. Брёнстеда и амер. физикохимика Г. Н. Льюиса
(1923). Брёнстед относит к классу кислот водородсодержащие вещества,
отдающие при реакциях положительные ионы водорода - протоны (т. н. протонные,
или брёнстедовские, кислоты), а к классу оснований - вещества, присоединяющие
протоны. Функции К. и о., по Брёнстеду, могут выполнять как нейтральные
молекулы, так и ионы. Хим. реакция, при к-рой происходит передача протона
от кислоты к основанию: АН + В- -> А- + ВН (где АН - кислота, а В- - основание),
наз. кислотно-основной, или протолитической. Поскольку протолитич. реакции
обратимы, причём в обратной реакции, так же как и в прямой, происходит
передача протона, продукты прямой реакции также выполняют друг по отношению
к другу функции К. и о. (т. н. сопряжённые К. и о.), т. е. ВН -
кислота, а А- основание. Напр., в реакции: H
кислотами являются H
a HSO
позволяет выражать в количеств, форме основные характеристики протолитич.
равновесий и расположить водородсодержащие вещества в ряд по возрастанию
их способности отдавать протон, т. е. по их кислотности. Эти достоинства
теории протолитич. равновесий обусловили её предсказательную силу и обеспечили
широкое использование брёнстедовских представлений в хим. практике. В то
же время концепции Брёнстеда свойственна ограниченность, выражающаяся в
том, что, связывая кислотные свойства вещества с наличием в его составе
водорода, она всё же оставляет в стороне большое число веществ кислотного
характера, не содержащих водорода. К таким веществам, получившим в химии
назв. а протонных, или льюисовских, кислот, относятся электронно-ненасыщенные
соединения, напр, галогениды бора, алюминия и олова, окислы нек-рых металлов
и т. д. Согласно концепции Льюиса, восполняющей в какой-то степени вышеуказанный
пробел, кислотой наз. вещество, присоединяющее при хим. реакции пару электронов,
а основанием - вещество, отдающее пару электронов. Результатом является
восполнение электронной ненасыщенности молекулы кислоты за счёт электронов
основания, а также возникновение нового соединения (соли) с устойчивой
электронной оболочкой (в частности, октетом) и донорно-акцепторной
связью, напр.:
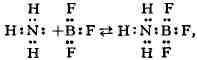
в обобществлении электронной пары основания. Этим они отличаются от окислительно-восстановительных
реакций, в ходе к-рых молекулы окислителя полностью отбирают по одному
или неск. электронов у молекул восстановителя; никаких обобществлённых
орбит при этом не возникает. В отличие от Брёнстеда, Льюис связывает кислотно-основные
свойства не с наличием определённых хим. элементов (в частности, водорода),
а исключительно со строением внешних электронных оболочек атомов. В то
же время между обеими концепциями имеется внутр. связь, основанная на том,
что для иона Н+, так же как и для льюисовских кислот, характерно
сильное сродство к электронной паре. Кроме двух рассмотренных концепций
К. и о., известны нек-рые другие, к-рые не получили, однако, столь широкого
распространения.
теории К. и о. широко применяются на практике. Изменение кислотности или
основности среды часто используют с целью увеличения скорости реакций и
изменения механизма взаимодействия. В этом состоит сущность кислотно-основного
катализа,
широко
используемого в хим. пром-сти; при этом важно, что брёнстедовские и лыоисовские
кислоты оказывают во многих случаях сходное каталитич. действие. Широкое
применение получили кислотно-основные процессы в хим. пром-сти
(нейтрализация,
гидролиз, травление металлов и т. д.). Мн. кислоты (серная,
азотная, соляная, ортофосфорная и др.)
и щёлочи (едкое кали, едкий
натр и др.) являются основными продуктами хим. произ-ва и используются
в качестве исходных веществ в важнейших отраслях хим. пром-сти.
- функции К. и о. выполняют в живых организмах, принимая участие во многих
биохим. процессах. Как правило, эти процессы очень чувствительны к кислотности
или основности среды (см. Водородный показатель, Кислотно-щелочное равновесие).
Направленное
воздействие К. и о. используется в медицине. Так, разбавленные растворы
соляной кислоты употребляются для усиления секреции желудка, борной - для
дезинфицирующих и вяжущих полосканий и т. д. В то же время при попадании
в организм концентрированных К. и о. возможны сильные ожоги внутр. органов,
падение сердечной деятельности и т. д., приводящие в ряде случаев к гибели
организма.
Электронная теория кислот и оснований, пер. с англ., М., 1950; Усанович
М. И., Что такое кислоты и основания, А.-А., 1953; П о л и н г Л., Общая
химия, пер. с англ., М., 1964; Краткая химическая энциклопедия, т. 2, М.,
1963. Я. М. Варшавский.