КАЛЬЦИЙ
(Calcium), Ca, химич.
элемент II группы периодич. системы Менделеева, ат. н. 20, ат. м. 40,08;
серебряно-белый лёгкий металл. Природный элемент представляет смесь шести
стабильных изотопов: 40Ca, 42Ca, 43Ca,
44Ca,
46Ca
и 48Ca, из к-рых наиболее распространён
40Ca (96,
97%).
Соединения Ca - известняк, мрамор,
гипс (а также известь - продукт обжига известняка) уже в глубокой древности
применялись в строит, деле. Вплоть до кон. 18 в. химики считали известь
простым телом. В 1789 А. Лавуазье предположил, что известь, магнезия,
барит, глинозём и кремнезём - вещества сложные. В 1808 Г. Дэви, подвергая
электролизу с ртутным катодом смесь влажной гашёной извести с окисью ртути,
приготовил амальгаму Ca, а отогнав из неё ртуть, получил металл, названный
"кальций" (от лат. calx, род. падеж calcis - известь).
Распространение в природе. По распространённости
Огромную роль в истории Ca играет и
Огромные территории с влажным климатом
Реки приносят в океан много Ca, но
Важную роль в миграции Ca играют подземные
В ходе геологич. истории росло биогенное
Физические и химические свойства. Кристаллич.
Конфигурация внешней электронной оболочки
Получение и применение. В пром-сти
В виде чистого металла Ca применяют
Кальций в организме. Ca - один из биогенных
Содержание Ca в крови человека и высших
И. А. Скульский.
В медицине применение препаратов Ca
К препаратам Ca относится также гипс
Лит.: Краткая химическая энциклопедия,
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
в земной коре Ca занимает 5-е место (после О, Si, Al и Fe); содержание
2,96% по массе. Он энергично мигрирует и накапливается в различных геохимич.
системах, образуя 385 минералов (4-е место по числу минералов). В мантии
Земли Ca мало и, вероятно, ещё меньше в земном ядре (в железных метеоритах
0,02%).
Ca преобладает в нижней части земной коры, накапливаясь в осн. породах;
большая часть Ca заключена в полевом шпате - анортите Ca[AbSi
биосфере происходит исключительно резкая дифференциация Ca, связанная гл.
обр. с "карбонатным равновесием": при взаимодействии углекислого газа с
карбонатом СаСОз образуется растворимый бикарбонат Ca(HCOa)
биогенная миграция. В живом веществе из элементов-металлов Ca - главный.
Известны организмы, к-рые содержат более 10% Ca (больше углерода), строящие
свой скелет из соединений Ca, гл. обр. из СаСОз (известковые водоросли,
MH. моллюски, иглокожие, кораллы, корненожки и т. д.). С захоронением скелетов
мор. животных и растений связано накопление колоссальных масс водорослевых,
коралловых и прочих известняков, к-рые, погружаясь в земные глубины и минерализуясь,
превращаются в различные виды мрамора.
(лесные зоны, тундра) характеризуются дефицитом, Ca - здесь он легко выщелачивается
из почв. С этим связано низкое плодородие почв, низкая продуктивность домашних
животных, их малые размеры, нередко болезни скелета. Поэтому большое значение
имеет известкование почв, подкормка домашних животных и птиц и т. д. Напротив,
в сухом климате СаСОз труднорастворим, поэтому ландшафты степей и пустынь
богаты Ca. В солончаках и солёных озёрах часто накапливается гипс CaSO
он не задерживается в океанич. воде (ср. содержание 0,04%), а концентрируется
в скелетах организмов и после их гибели осаждается на дно преим. в форме
CaCO
СаСОз, организмы там нередко испытывают дефицит Ca).
воды. В известняковых массивах они местами энергично выщелачивают CaCO
сталагмитов. Помимо кальцита, в морях прошлых геологических эпох было широко
распространено отложение фосфатов Ca (напр., месторождения фосфоритов Каратау
в Казахстане), доломита CaCO
карбонатообразование, а химич. осаждение кальцита уменьшалось. В докемб-рийских
морях (св. 600 млн. лет назад) не было животных с известковым скелетом;
они приобрели широкое распространение начиная с кембрия (кораллы, губки
и т. д.). Это связывают с высоким содержанием CO
решётка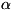 -формы Ca (устойчивой при
-формы Ca (устойчивой при
обычной темп-ре) гранецентрированная кубическая, а = 5,56 А. Атомный
радиус 1,97А, ионный радиус Ca2+, 1,04 А. Плотность 1,54 г/см3(20
0C).
Выше 464 0C устойчива гексагональная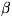 -форма.
-форма.
t
коэфф. линейного расширения 22-10-6 (0-300 0C); теплопроводность
при 20 0C 125,6 Вт/(м-К) или 0,3 кал!(см-сек
0"C);
удельная
теплоёмкость (0-100 0C) 623,9
дж/(кг-К) или 0,149 кал!(г-
0C); удельное электросопротивление при 20 0C
4,6-10-8 ом-м или 4,6-10-6ом-см;
температурный
коэфф. электросопротивления 4,57-10-3 (20
0C). Модуль
упругости 26Гн/м2 (2600 кгс/мм2);
предел
прочности при растяжении 60 Мн/л2 (6 кгс/мм2);
предел
упругости 4 Мн/л2 (0,4 кгс/мм2), предел текучести
38 Мн/м2 (3,8 кгс/мм2); относительное
удлинение 50%; твёрдость по Бринеллю 200-300 Мн/м2 (20-30
кгс/мм2).
К.
достаточно высокой чистоты пластичен, хорошо прессуется, прокатывается
и поддаётся обработке резанием.
атома Ca 4s2, в соответствии с чем Ca в соединениях 2-валентен.
Химически Ca очень активен. При обычной темп-ре Ca легко взаимодействует
с кислородом и влагой воздуха, поэтому его хранят в герметически закрытых
сосудах или под минеральным маслом. При нагревании на воздухе или в кислороде
воспламеняется, давая осн. окисел CaO (см. Кальция окись). Известны
также перекиси Ca - CaO
образования плёнки Ca(OH)
энергично взаимодействует с горячей водой и кислотами, выделяя H
и бромом - выше 400 0C, давая соответственно CaF
Кальция бромид). Эти галогениды в расплавленном состоянии образуют
с Ca т. н. субсоединения - CaF, CaCl, в к-рых Ca формально одновалентен.
При нагревании Ca с серой получается кальция сульфид CaS, последний
присоединяет серу, образуя полисульфиды (CaS
образует гидрид CaH
Ca [NH
и др.
Ca получают двумя способами: 1) нагреванием брикетированной смеси CaO и
порошка Al при 1200 0C в вакууме 0,01-0,02 мм рт. ст.; выделяющиеся
по реакции: 6 CaO + 2 Al = = 3CaO-Al
и KCl с жидким медно-кальциевым катодом приготовляют сплав Cu - Ca (65%
Ca), из к-рого Ca отгоняют при темп-ре 950-1000 0C в вакууме
0,1-0,001 мм рт. ст.
как восстановитель U, Th, Cr, V, Zr, Cs, Rb и нек-рых редкоземельных металлов
из их соединений. Его используют также для раскисления сталей, бронз и
др. сплавов, для удаления серы из нефтепродуктов, для обезвоживания ор-ганич.
жидкостей, для очистки аргона от примеси азота и в качестве поглотителя
газов в электровакуумных приборах. Большое применение в технике получили
антифрикционные
материалы системы Pb - Na - Ca, а также сплавы Pb-Ca, служащие для
изготовления оболочки электрич. кабелей. Сплав Ca - Si - Ca (силикокальций)
применяется как рас-кислитель и дегазатор в произ-ве качественных сталей.
О применении соединений К. см. в соответствующих статьях. А. Я. Фишер,
А. И. Перельман.
элементов, необходимых для нормального протекания жизненных процессов.
Он присутствует во всех тканях и жидкостях животных и растений. Лишь редкие
организмы могут развиваться в среде, лишённой Ca. У нек-рых организмов
содержание Ca достигает 38%; у человека - 1,4-2%. Клетки растит, и животных
организмов нуждаются в строго определённых соотношениях ионов Ca2+,
Na+ и K+ во внеклеточных средах. Растения получают
Ca из почвы. По их отношению к Ca растения делят на кальцефилов и
кальцефобов.
Животные
получают Ca с пищей и водой. Ca необходим для образования ряда клеточных
структур, поддержания нормальной проницаемости наружных клеточных мембран,
для оплодотворения яйцеклеток рыб и др. животных, активации ряда ферментов.
Ионы Ca2+ передают возбуждение на мышечное волокно, вызывая
его сокращение, увеличивают силу сердечных сокращений, повышают фагоцитарную
функцию лейкоцитов, активируют систему защитных белков крови, участвуют
в её свёртывании. В клетках почти весь Ca находится в виде соединений с
белками, нуклеиновыми к-тами, фос-фолипидами, в комплексах с неорганич.
фосфатами и органич. к-тами. В плазме крови человека и высших животных
только 20-40% Ca может быть связано с белками. У животных, обладающих скелетом,
до 97-99% всего Ca используется в качестве строит, материала: у беспозвоночных
в основном в виде CaCO
нового скелета или для обеспечения жизненных функций в неблагоприятных
условиях.
животных регулируется гормонами паращитовидных и щитовидной желез. Важнейшую
роль в этих процессах играет витамин D. Всасывание Ca происходит в переднем
отделе тонкого кишечника. Усвоение Ca ухудшается при снижении кислотности
в кишечнике и зависит от соотношения Ca, P и жира в пище. Оптимальные соотношения
Са/Р в коровьем молоке ок. 1,3 (в картофеле 0,15, в бобах 0,13, в мясе
0,016). При избытке в пище P или щавелевой к-ты всасывание Ca ухудшается.
Желчные к-ты ускоряют его всасывание. Оптимальные соотношения Са/жир в
пище человека 0,04-0,08 г Ca на 1 г жира. Выделение Ca происходит гл. обр.
через кишечник. Млекопитающие в период
лактации
теряют
много Ca с молоком. При нарушениях фосфорно-кальциевого обмена у молодых
животных и детей развивается рахит, у взрослых животных - изменение
состава и строения скелета (остеомаляция).
устраняет нарушения, связанные с недостатком ионов Ca2+ в организме
(при тетании, спазмофилии, рахите). Препараты Ca снижают повышенную чувствительность
к аллергенам и используются для лечения аллергич. заболеваний (сывороточная
болезнь, крапивница, ангионевротич. отёк, сенная лихорадка и др.). Препараты
Ca уменьшают повышенную проницаемость сосудов и оказывают противовоспалительное
действие. Их применяют при геморрагич. васку-лите, лучевой болезни, воспалительных
и экссудативных процессах (пневмония, плеврит, эндометрит и др.) и нек-рых
кожных заболеваниях. Назначают как кровоостанавливающие средства, для улучшения
деятельности сердечной мышцы и усиления действия препаратов наперстянки;
как слабые мочегонные и как противоядия при отравлении солями магния. Вместе
с др. средствами препараты Ca применяют для стимулирования родовой деятельности.
Хлористый кальций вводят через рот и внутривенно. Оссо-кальцинол (15%-ная
стерильная суспензия .особым образом приготовленного костного порошка в
персиковом масле) предложен для тканевой терапии.
(CaSO
т. 2, M., 1963, с. 370 - 75; P о д я-кин В. В., Кальций, его соединения
и сплавы, M., 1967; К а п л а н с к н и С. Я., Минеральный обмен, M.- Л.,
1938; В и ш-н я к о в С. И., Обмен макроэлементов у сельскохозяйственных
животных, M., 1967.