ИОННЫЙ ОБМЕН
обмен
При выпаривании
При гетерогенном
Гетерогенный
К. В. Чмутов.
ионов в растворах электролитов (гомогенный И. о.). При смешении разбавленных
растворов электролитов, напр. NaCl и KNO
Cl-. Равновесное состояние выразится в этом случае уравнением:
NaCl + KNO
меньше других, равновесие сдвигается в сторону образования малодиссоциированного
вещества. Равновесие сдвигается также в сторону образования летучего или
малорастворимого продукта (если он выделяется из данной фазы) по реакциям:
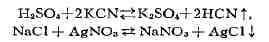
равновесного раствора прежде всего начинается кристаллизация соли (комбинации
ионов), обладающей меньшей растворимостью. Избирательность кристаллизации
может быть вызвана также добавлением органич. растворителей (спирт, ацетон,
диоксан и т. п.).
И. о. (ионообменная сорбция) обмен происходит между ионами, находящимися
в растворе, и ионами, присутствующими на поверхности твёрдой фазы - иони-та-
При соприкосновении ионита, насыщенного одним ионом, напр. H+,
с раствором, содержащим др. ионы, напр. Na+ и Ca2+,
происходит обмен ионов между раствором и ионитом: в растворе уменьшаются
концентрации Na+ и Ca2+ и появляется эквивалентное
количество ионов H+.
И. о. имеет место при сорбции из растворов электролитов на нек-рых минералах
(алюмосиликатах, гидратах окисей металлов, цеолитах), в клетках и мембранах
живых организмов и в синтетич. ионообменных сорбентах. Гетерогенный И.
о. широко применяется для обессоливания воды, идущей для питания котлов
паром высоких параметров, в гидрометаллургии, в хим. и фарма-цевтич. пром-сти
(см. Ионыты).
А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Ъ Ы Ь Э Ю Я