ИЗОТОПЫ
(от
изо... и греч. topos- место), разновидности одного хим. элемента, занимающие
одно место в пери-одич. системе элементов Менделеева, но отличающиеся массами
атомов. Хим. свойства атомов, т. е. принадлежность атома к тому или иному
хим. элементу, зависят от числа электронов и их расположения в электронной
оболочке атома (см. Атом). Место хим. элемента в пе-риодич. системе элементов
определяется его порядковым номером Z, равным числу электронов в оболочке
атома или, что то же самое, числу протонов, содержащихся в атомном ядре.
Кроме протонов , в ядро атома входят нейтроны, масса каждого из к-рых приблизительно
равна массе протона. Количество нейтронов N в ядре атома с данным Z может
быть различным, но в определённых пределах. Напр., в ядре атома гелия (Z
= 2) может содержаться 1, 2, 4 или 6 нейтронов. Полное число протонов Z
и нейтронов N в ядре (наз. общим термином нуклоны) определяет массу ядра
и по существу массу всего атома. Это число А - Z + N наз. массовым числом
атома. От соотношения чисел протонов и нейтронов в ядре зависят стабильность
или нестабильность ядра, тип распада радиоактивного ядра, спин, магнитный
дипольный момент, электрический квадруполъный момент ядра и нек-рые др.
его свойства (см. Ядро атомное). T. о., атомы с одинаковым Z, но с различным
числом нейтронов N обладают идентичными хим. свойствами, но имеют различные
массы и различные ядерные свойства. Эти разновидности атомов также наз.
И. Для обозначения любых разновидностей атомов, независимо от их принадлежности
к одному элементу, применяют термин нуклиды.
Массовое число
И. приводится сверху слева от хим. символа элемента. Напр., И. гелия обозначаются:
3He,
4He,
8He, 8He. Более развёрнутые обозначения:
1 Массы атомов
Первое доказательство
После того
В 1934 И. Кюри
Анализ соотношений
Элементы с
Такие широкие
Все стабильные
Для нуклидов,
Единство образования
Возможность
Важной проблемой
Лит.: Астов
H. И. Тарантин.
2
4
и 6
протонов Z, верхний левый индекс - число нейтронов N, а верхний правый
- массовое число. При обозначении И. без применения символа элемента массовое
число А даётся после наименования элемента: ге-лий-3, гелий-4 и т. п.
M, выраженные в атомных единицах массы, лишь немного отличаются от целых
чисел. Поэтому разность M - А всегда правильная дробь, по абс. величине
меньше 1/2, и т. о. массовое число А есть ближайшее к массе атома M целое
число. Знание массы атома определяет полную энергию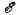
связи всех нуклонов в ядре. Эта энергия выражается соотношением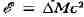
, где с - скорость света в вакууме,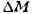 -
-
разность между суммарной массой всех входящих в ядро нуклонов в свободном
состоянии и массой ядра, к-рая равна массе нейтрального атома без массы
всех электронов.
того, что вещества, имеющие одинаковое хим. поведение, могут иметь различные
физ. свойства, было получено при исследовании радиоактивных превращений
атомов тяжёлых элементов. В 1906-07 выяснилось, что продукт радиоактивного
распада урана - ионий и продукт радиоактивного распада тория - радиоторий
имеют те же хим. свойства, что и торий, однако отличаются от последнего
атомной массой и характеристиками радиоактивного распада. Более того, как
было обнаружено позднее, все три элемента имеют одинаковые оптические и
рентгеновские спектры. Такие вещества, идентичные по хим. свойствам, но
различные по массе атомов и нек-рым физ. свойствам, по предложению англ,
учёного Ф. Содди, стали называть И.
как И. были обнаружены у тяжёлых радиоактивных элементов, начались поиски
И. у стабильных элементов. В 1913 англ, физик Дж. Том-сон обнаружил И.
у неона. Разработанный им метод парабол позволял определить отношение массы
иона к его заряду по отклонению в параллельно направленных электрическом
и магнитном полях тонкого пучка положительных ионов, получаемых в высоковольтном
электрич. разряде (см. Масс-спектрометры). Наряду с атомами 20Ne
Том-сон наблюдал небольшую примесь более тяжёлых атомов. Однако убедительных
доказательств того, что вторая компонента более тяжёлых атомов является
И. неона, получено не было. Лишь с помощью первого масс-спектрографа, построенного
в 1919 англ, физиком Ф. Астоном, были получены надёжные доказательства
существования двух И. 20Ne и 22Ne, относит, содержание
(распространённость) к-рых в природе составляет приблизительно 91% и 9%
. В дальнейшем был обнаружен изотоп 21Ne с распространённостью
0,26%, И. хлора, ртути и ряда др. элементов. Примерно к 1940 изотопный
анализ был осуществлён для всех существующих на Земле элементов. В результате
этого были выявлены и идентифицированы практически все стабильные и долгоживущие
радиоактивные И. природных элементов.
и Ф. Жолио получили искусств, путём радиоактивные И. азота (13N),
кремния (28Si) и фосфора (30P), отсутствующие в природе.
Этими экспериментами они продемонстрировали возможность синтеза новых радиоактивных
нуклидов. В последующие годы с помощью ядерных реакций под действием нейтронов
и ускоренных заряженных частиц было синтезировано большое число радиоактивных
И. известных элементов, а также получено ок. 20 новых элементов. Известно
276 стабильных И., принадлежащих 81 природному элементу, и ок. 1500 радиоактивных
И. 105 природных и синтезированных элементов.
между числами нейтронов и протонов для различных И. одного и того же элемента
показывает, что ядра стабильных И. и радиоактивных И., устойчивых по отношению
к бета-распаду, содержат на каждый протон не менее одного нейтрона. Исключение
из этого правила составляют лишь два нуклида -1H и 3He.
По мере перехода ко всё более тяжёлым ядрам отношение числа нейтронов к
числу протонов в ядре растёт и достигает 1,6 для урана и трансурановых
элементов.
нечётным Z имеют не более двух стабильных И. Как правило, число нейтронов
N в таких ядрах чётное, и, следовательно, массовое число А - нечётное.
Большинство элементов с чётным Z имеет несколько стабильных И., из к-рых
не более двух с нечётным А. Наибольшее число И. (10) имеет олово, 9 И.-
у ксенона, 8- у кадмия и теллура. Многие элементы имеют 7 И.
вариации в числе стабильных И. у различных элементов обусловлены сложной
зависимостью энергии связи ядра от числа протонов и нейтронов в ядре. По
мере изменения числа нейтронов N в ядре с данным числом протонов Z энергия
связи ядра и его устойчивость по отношению к различным типам распада меняются.
При добавлении нейтронов ядро становится неустойчивым по отношению к испусканию
электрона с превращением одного нейтрона в ядре в протон (см. Ядро атомное).
Поэтому нейтронообогащённые И. всех элементов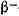
-активны (см. Бета-распад). Наоборот, при обеднении нейтронами ядро получает
возможность или захватить электрон из оболочки атома, или испустить позитрон.
При этом один протон превращается в нейтрон и оптимальное соотношение между
числом протонов и нейтронов в ядре восстанавливается. Нейтронообед-нённые
И. всех элементов испытывают или электронный захват или позитрон-ный распад.
У тяжёлых ядер наблюдаются также альфа-распад и самопроизвольное (спонтанное)
деление ядер. Получение нейтроноизбыточных И. элементов возможно неск.
способами. Один из них - реакция захвата нейтронов ядрами стабильных И.
Другой - деление тяжёлых ядер под действием нейтронов или заряженных частиц,
в результате к-рого из одного тяжёлого ядра с большим относительным содержанием
нейтронов образуются два нейтррнообога-щённых ядра. Нейтронообогащённые
И. лёгких элементов эффективно образуются в реакциях многонуклонного обмена
при взаимодействии ускоренных тяжёлых ионов с веществом. Синтез нейтроно-дефицитных
И. осуществляется в ядерных реакциях под действием ускоренных заряженных
лёгких частиц или тяжёлых ионов.
И. на Земле возникли в результате ядерных процессов, протекавших в отдалённые
времена, и их распространённость зависит от свойств ядер и от первоначальных
условий, в к-рых происходили эти процессы. Изотопный состав природных элементов
на Земле, как правило, постоянен. Это объясняется тем, что он не подвергается
Значит, изменениям в хим. и физ. процессах, протекающих на Земле. Однако
небольшие колебания в относительной распространённости И. всё же наблюдаются
для лёгких элементов, у к-рых различие в массах атомов И. относительно
велико. Эти колебания обусловлены изменением изотопного состава элементов
(фракционированием И.), происходящим в результате диффузии, изменения агрегатного
состояния вещества, при нек-рых хим. реакциях и др. процессах, непрерывно
протекающих в атмосфере и земной коре (см. Изотопов разделение, Изотопные
методы в геологии. Изотопный обмен). Изменение изотопного состава элементов,
интенсивно мигрирующих в биосфере (H, С, N,O, S), связано и с деятельностью
живых организмов.
образующихся в результате радиоактивного распада, напр. для И. свинца,
различное содержание И. в разных образцах обусловлено разным первоначальным
содержанием их родоначальников (U или Th) и разным геол. возрастом образцов
(см. Геохронология, Macс-спектроскопия, Радиоактивность).
тел Солнечной системы позволяет думать, что изотопный состав элементов
земных образцов характерен для всей Солнечной системы в целом (при наличии
известных колебаний). Метеоры и глубокие слои земной коры показывают примерно
одинаковое отношение 16О/18О Астрофизические исследования
обнаруживают отклонения изотопного состава элементов, составляющих звёздное
вещество и межзвёздную среду, от земного. Напр., для углеродных R-звёзд
отношение 12С/13С изменяется от 4-5 до земного значения.
примешивать к природным хим. элементам их радиоактивные И. позволяет следить
за различными хим. и физ. процессами, в к-рых участвует данный элемент,
с помощью детекторов радиоактивных излучений. Этот метод получил широкое
применение в биологии, химии, медицине, а также в технике. Иногда примешивают
стабильные И., присутствие к-рых обнаруживают в дальнейшем масс-спектральными
методами (см. Изотопные индикаторы).
является выделение отд. И. из их природной или искусственно полученной
смеси или обогащение этой смеси к.-л. И.
Ф. В., Масс-спектры и изотопы, пер. с англ., М., 1948; Кравцов В. А., Массы
атомов и энергии связи ядер, М., 1965; Lederer С. М., Hollander J. М.,
Per 1m an I., Table of isotopes, 6 ed., N. Y.-[a. o.], 1967.
А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Ъ Ы Ь Э Ю Я