ИЗОТОПНЫЙ ОБМЕН
хим. процесс, заключающийся в перераспределении изотопов к.-л.
элемента между реагирующими веществами. При И. о. происходит замещение
одного изотопа к.-л. элемента на другой его изотоп в молекулах данного
вещества без изменения их
элементарного
Возможности
Поскольку хим.
И. о. применяют
или
В хим. исследованиях
Лит.: Бродский
С. д. Вайсберг.
состава. Напр., если хлористый водород HCl, обогащённый тяжёлым изотопом
хлора 37Cl, смешать с хлором Cl
реакций И. о. хлор обогатится тяжёлым изотопом,< а хлористый водород
обеднится им.
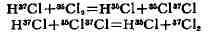
протекания реакций И. о. весьма различны: они могут идти в гомогенных условиях
(между растворённым веществом и растворителем, в смеси газов и т. д.),
а также в гетерогенных (напр., между твёрдым или жидким веществом и нерастворимым
газом). Механизмы реакций И. о. не отличаются от механизмов др. хим. реакций.
свойства изотопов одного и того же элемента почти одинаковы, а относительные
различия в массах их атомов невелики (за исключением изотопов водорода),
то при достижении хим. равновесия И. о. каждый изотоп распределяется между
реагирующими веществами почти равномерно. Для изотопов тяжёлых элементов
неравномерность не превышает десятых долей процента, для изотопов лёгких
элементов (от Li до Cl) не превышает 10% . Только для изотопов водорода
неравномерность в распределении между нек-рыми веществами достигает сотен
процентов. Распределение изотопов между веществами в состоянии равновесия
характеризуется коэфф. распределения а, определяющим соотношение равновесных
концентраций изотопов в реагирующих веществах. При равномерном распределении
изотопов а = 1. Отклонение от равномерного распределения зависит не только
от массы изотопов, но и от хим. состава веществ, между к-рыми происходит
И. о. Кроме того, а зависит от темп-ры и во всех случаях по мере её повышения
приближается к 1. Скорость протекания И. о. всецело определяется механизмом
реакций. В нек-рых случаях И. о. протекает практически мгновенно (напр.,
при ионных реакциях в растворе), в др. случаях - крайне медленно или же
не происходит вовсе. Для ускорения И. о. так же, как и для др. хим. реакций,
часто используют различные катализаторы.
для концентрирова-ния требуемого изотопа. Для этого многократно повторяют
процесс обогащения этим изотопом одного из веществ при условии неравномерного
распределения изотопов между веществами. Для изотопов водорода и лития,
нашедших применение в атомной и термоядерной энергетике, такие методы получили
пром. использование. К ним относится, напр., получение тяжёлой воды путём
И. о. воды и сероводорода или И. о. воды и водорода:
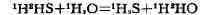
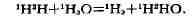
И. о. применяют для выяснения элементарных стадий различных реакций. По
скорости протекания И. о. можно иногда лучше, чем по др. реакциям, судить
о подвижности атомов в молекулах и о реакционной способности хим. соединении.
И. о. используют также в препаративных работах для получения меченых соединений
(см. Изотопные индикаторы).
А. И., Химия изотопов, 2 изд. , M., 1957; РогинскийС. 3., Теоретические
основы изотопных методов изучения химических реакций, M., 1956.
А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Ъ Ы Ь Э Ю Я