ИЗОМОРФИЗМ
(от
Особенно часто
Лит.: Вернадский
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
изо... и греч. morphe - вид, форма), свойство веществ, аналогичных по хим.
составу, кристаллизоваться в одинаковых формах. Впервые было показано нем.
минералогом Э. Мичерлихом (1819) на примере KH
("твёрдые растворы") с единой внешней формой при произвольном отношении
P:As, в то время как в др. парах аналогичные замещения ограничены количественно.
Первый случай отвечает понятию "совершенный И.", а второй - понятию "ограниченный",или
"несовершенный И.". Если количества замещающего элемента невелики, но существенны
для поисковика минералога-геохимика, то говорят об эндокриптии (по A. E.
Ферсману, замещение узлов кристаллич. решёток ионами того же знака, но
разных свойств и мало сходных величин). Требование родственности взаимозамещающихся
элементов при И. первоначально понималось как чисто хим. близость, и первые
ряды изоморфных элементов (В. И. Вернадский; см. Геохимия) повторяли группы
менделеевской системы с некоторыми дополнениями известных из аналитич.
химии групп, например Al, Cr, Fe. Выяснилось, однако, что невозможно, напр.,
замещение Na на Rb; твёрдые растворы К- и Na-соединений энергично распадаются
при низких темп-pax (распад K-, Na-полевых шпатов). Решающим для объяснения
этих явлений при И. было введение (В. M. Голъдшмидт, 1926) представления
об ионных радиусах, близость к-рых стала одним из основных условий И. У
полновалентных катионов (Na1+, Mg2+, ..., S6+,...)
ионный радиус г быстро уменьшается вдоль строки менделеевской системы и
резко увеличивается вдоль вертикали на величины, большие чем 10-15% (экспериментальный
предел для возможности И.). В результате изоморфными оказываются элементы,
соседние по диагоналям (Д. И. Менделеев, A. E. Ферсман), напр.ряд Na-Ca(r
и именно благодаря постоянному изоморфному вхождению редкоземельных элементов
в Са-минералы эти элементы долгое время считались двухвалентными (только
Д. И. Менделеев перевёл их в III группу). Др. характерные "диагональные"
пары: Li-Mg, Mo-Re,
строки заходит так далеко, что катионы одной и той же менделеевской группы
выравнивают свои радиусы, т. е. у элементов одной группы, разделённых по
вертикали "лантанидным сжатием", И. становится весьма ярко выраженным.
Это относится к ларам Ba-Ra, Zr - Hf, Nb-Та и др. Но как ни близки между
собой Nb и Та, их легче отделить друг от друга, чем отделить от Ti, с к-рым
они связаны диагональным изоморфизмом. T. о., изовалентный И. представлен
намного скромнее (во всяком случае количественно), чем гетеровалент-ный
И. Возникает вопрос, как компенсировать в структуре кристалла изменение
валентности, напр, её увеличение при И. Ca2+ -> Na1+.
Решение просто, когда элемент на середине диагонали замещается двумя соседними
по разные стороны,напр.
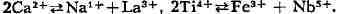
компенсация достигается за счёт одновременного гетеровалент-ного И. "в
обратном направлении". В плагиоклазах замена Ca2+ на Na1+
сопровождается параллельно замещением Al3+ на Si4+: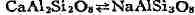
Возникает вопрос, как быть с радиусами Si4+(0,39A)< и
Al3+ (0,57A), различающимися на 46%. Значит, разница между радиусами
не является препятствием при гетеровалентном И., т. к. в анионной, более
отрицательной части соединений заменяют друг друга не атомы, а тетра-эдрические
группы, напр. SiO4-
лишь на 9%. Литий, напр., в более "катионной" форме, имеющий координацию
6, замещает по правилу диагонали Mg (в биотитах); находясь же среди четырёх
О, способен заменить Be в берилле: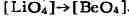
Разобранные закономерности касаются в основном случаев изоморфных замещений
между полновалентными ионами типа "благородных газов" в соединениях, к-рые
подчиняются законам элементарной энергетики (формулы А. Ф. Капустинского).
Для переходных металлов, образующих соединения существенно ковалентного
типа и стремящихся создать возле себя за счёт донор-ско-акцепторного механизма
группы электронов 8, 13-14, 18, закономерности И. иные. Так, в случае пары
элементов с одним и тем же радиусом, напр. Zn2+ и Fe2+,
мы встречаемся с односторонним И. Цинк в своём гл. соединении ZnS (сфалерит)
допускает вхождение до 20% Fe, но Zn совершенно отсутствует в FeS. Причина
лежит в возможности для Fe иметь как шестерную координацию, так и четверную,
тогда как для Zn всегда в сульфидах-четверная координация. И. очень распространён
в природе. Широким развитием изоморфных замещений объясняется сложный хим.
состав большинства минералов, особенно из группы силикатов. Примером совершенного
И. являются минералы переменного состава, дающие непрерывные ряды: плагиоклазы,
скаполиты, вольфрамиты и др. Законы изоморфного замещения объясняют распределение
редких элементов, находящихся в виде примесей в горных породах и рудах.
Так, значит, часть иттрия и редких земель находится в апатите, сфене и
флюорите, изоморфно замещая кальций; трёхвалентный ванадий замещает в магнетите
окисное железо; селен - серу в пирите и т. д. Учение об И. является основой
для изучения форм нахождения элементов в горных породах и процессов концентрации
и рассеяния хим. элементов в земной коре.
В. И., Очерки геохимии, 4 изд., M.- Л., 1934; Ферсман A. E., Геохимия,
2 изд., т. 1, Л., 1934; Менделеев Д. И., Соч., т. 1, Л., 1937; Гольдшмидт
В. M., Кристаллохимия, пер. с нем.. Л., 1937; Сто лет периодического закона
химических элементов, M., 1969. Н.В.Белов.