ИЗОМЕРИЯ
(от
изо... и греч.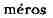 - доля, часть)
- доля, часть)
химических соединений, явление, заключающееся в существовании веществ<,
одинаковых
по составу и молекулярной массе, но различающихся по строению или расположению
атомов в пространстве и вследствие этого по физическим и химическим свойствам.
Такие вещества называются изомерами.
И. открыта
в 1823 Ю. Либихом, показавшим, что серебряная соль гремучей к-ты Ag-О-N
= C и изоцианат серебра Ag-N = C = O имеют один и тот же состав, но совершенно
разные свойства. Термин "И." предложен в 1830 И. Берцелиусом. Особенно
распространена И. среди органич. соединений. Явление изомерии было успешно
объяснено теорией хим. строения, разработанной в 60-х гг. 19 в. A. M. Бутлеровым.
Различают два
осн. вида И.: структурную и пространственную (стереоизо-м е р и ю). Структурные
изомеры отличаются друг от друга порядком связей между атомами в молекуле;
стереоизо-меры - расположением атомов в пространстве при одинаковом порядке
связей между ними.
Структурная
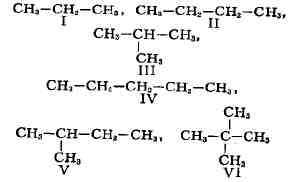
И. подразделяется на несколько разновидностей. И. скеле-т а обусловлена
различным порядком связи между атомами углерода, образующими скелет молекулы.
Так, может существовать только один нециклический насыщенный углеводород
с тремя атомами С - пропан (I). Углеводородов такого же типа с четырьмя
атомами С может быть уже два: и-бутан (II) и изобутан (III), а с пятью
атомами С - три: н-пентан (IV), изопентан (V) и нео-пентан (VI):
Для углеводорода
И. положения
Важную роль
В ряду алифатич.
Термин "метамерия"
И. непредельных
В большинстве
Особым видом
Пространственная
Для обозначения
Геометрич.
20 0C.
Для непредельных
Оптическая
Оптич. активностью
Чаще всего
Как видно из
Все хим. свойства
Для обозначения
Смесь равных
В случае соединений
(А Формы I и III,
Рацемич. соединения
Оптич. И. играет
Оптич. И. циклических
Хим. методами
У производных
Данный вид
(заторможенная
За исключением
Лит.: Илиел
Б. Л. Дяткин.
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
C
обусловлена различным положением к.-л. реакцион-носпособной группы (функциональной
группы, заместителя) при одинаковом углеродном скелете молекул. Так, пропану
соответствуют два изомерных спирта: н-пропиловый (VII) и изопро-пиловый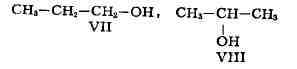
(VIII):
играет И. положения у соединений ароматич. ряда, т. к. положение заместителей
в бензольном ядре - один из гл. факторов, определяющих реакционную способность
вещества. Напр., о-динитробензол (IX) и га-дини-тробензол (X) легко реагируют
с аммиаком, тогда как м-динитробензол (XI) в реакцию с NH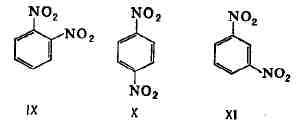
простых эфиров, сульфидов и аминов существует спец. вид И.- метамерия,
обусловленная различным положением гетероато-ма в углеродной цепи. Метамерами
являются, напр., метилпропиловый (XII) и диэтиловый (XIII) эфиры:
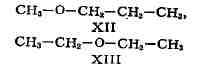
применяется всё реже.
соединений может быть вызвана различным положением кратной связи, как,
напр., в бутене-1 (XIV) и бутене-2 (XV), в винилуксусной (XVI) и кретоновой
(XVII) к-тах:
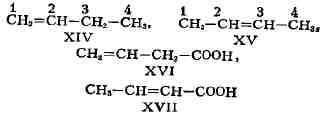
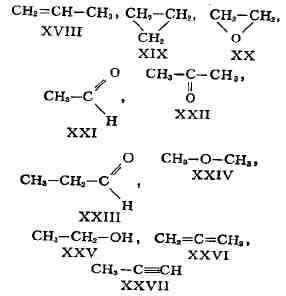
случаев структурные изомеры сочетают признаки И. скелета и И. положения,
содержат различные функциональные группы и принадлежат к разным классам
веществ, вследствие чего они отличаются друг от друга значительно больше,
чем рассмотренные выше изомеры веществ одного и того же типа. Напр., изомерами
являются пропилен (XVIII) и циклопропан (XIX), окись этилена (XX) и ацетальдегид
(XXI), ацетон (XXII) и пропионовый альдегид (XXIII), диметиловый эфир (XXIV)
и этиловый спирт (XXV), аллен (XXVI) и метилацетилен (XXVII):
структурной И. является таутомерия (равновесная динамическая И.) - существование
вещества в двух или более изомерных формах, легко переходящих друг в друга.
Так, ацетоуксусный эфир существует в виде равновесной смеси кетонной (XXVIII)
и енольной (XXIX) форм:
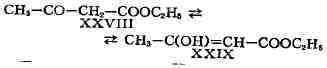
И. подразделяется на два вида: геометрическую И. (или цис-транс-Н.) и оптическую
И. Геометрическая И. свойственна соединениям, содержащим двойные связи
(C = C<, C = N и др.), и неароматич. циклическим соединениям; она
обусловлена невозможностью свободного вращения атомов вокруг двойной связи
или в цикле. В этих случаях заместители могут быть расположены либо по
одну сторону плоскости двойной связи или цикла (цис- положение), либо по
разные стороны (транс-положение). Понятия "цмс" и "транс" обычно относят
к паре одинаковых <заместителей, а если все заместители разные, то
условно к одной из пар. Примерами геометрич. изомеров могут служить две
формы этилен-1,2-дикарбоновой к-ты - цис-форма, или малеиновая к-та (XXX),
и трансформа, или фумаровая к-та (XXXI), а также цис- и торакс-формы циклопропан-1,2-дикарбоновой
к-ты (соответственно XXXII и XXXIII):
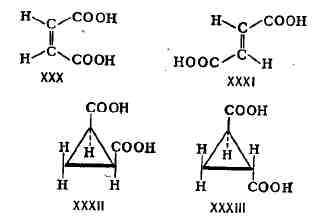
изомерных соединений, содержащих связи C = N или N = N, часто вместо цис
и транс применяют термины соответственно син и анти. Так, в молекуле син-бензальдоксима
(XXXIV) атом водорода при углероде и гидроксиль-ная группа при азоте расположены
по одну сторону плоскости, проходящей через C = N-CBHSb, а в молекуле анти-бензальдоксима
(XXXV) - по разные стороны этой плоскости:
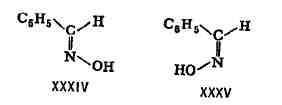
изомеры обычно существенно различаются по физ. свойствам (темп-рам кипения
и плавления, растворимости, дипольным моментам, термодинамич. устойчивости
и др.). В таблице приведены нек-рые свойства геометрич. изомеров - малеиновой
и фумаровой кислот.
физические свойства малеиновой и фумаровой кислот
кислота (цис-форма)
кислота (транс-форма)
плавления, 0C
в 100 г воды при
г
диссоциации при 25 0C (К,)
сгорания, кдж/моль (ккал/ моль)
соединений возможны переходы цисформы в трансформу и обратно; так, под
воздействием небольших количеств иода, галоленоводородов или др. реагентов
менее устойчивая, лабильная, форма переходит в более стабильную, тогда
как облучение ультрафиолетовым светом способствует обратному превращению.
Геометрич. изомеры различаются и нек-рыми хим. свойствами. Так, малеиновая
к-та, у к-рой карбоксильные группы пространственно сближены, легко образует
ма-леиновый ангидрид тогда как фумаровая к-та ангидрида не даёт.
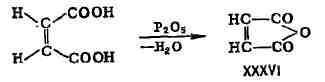
И. свойственна молекулам органич. веществ, не имеющим плоскости симметрии
(плоскости, разделяю-ц ей молекулу на две зеркально тождественные половины)
и не совмещающимся со своим зеркальным отображением (т. е. с молекулой,
соответствующей этому зеркальному отображению). Такие асимметричные молекулы
обладают оптической активностью - способностью к вращению плоскости поляризации
света при прохождении поляризованного луча через кристалл, расплав или
раствор вещества.
обладают кристаллы нек-рых неорганич. веществ, напр, кварца, однако оптич.
активность в этом случае обусловлена асимметрией кри-сталлич. решётки и
исчезает при переходе вещества в др. агрегатные состояния. Оптич. И. органич.
веществ зависит только от строения молекул и с агрегатным состоянием не
связана. Голл. химик. Я. Вант-Гофф впервые предложил (1874) объяснение
оптической активности на основе тетраэдрической модели атома углерода.
оптич. активность обусловлена наличием в молекуле асимметрия, атома углерода,
т. е. атома углерода, связанного с четырьмя различными заместителями. Примером
может служить молочная к-та: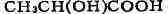
(асимметрический атом углерода отмечен звёздочкой). Согласно тетраэдрич.
модели атома углерода, заместители располагаются в углах правильного тетраэдра,
в центре к-рого находится атом углерода:
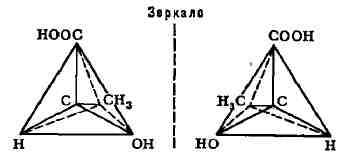
приведённых формул, молекула молочной к-ты ни при каком перемещении в пространстве
не может совпасть со своим зеркальным отображением. Эти две формы кислоты
относятся друг к другу, как правая рука к левой, и наз. оптич. антиподами
(энан-тномерами).
оптич. антиподов идентичны ;одинаковы и их физ. свойства, за исключением
оптич. активности: одна форма вращает плоскость поляризации света влево
[l-или (-)-форма], другая- на тог же по ведичине угол вправо [d-или ( +
)-форма]. Ясно, что две формы одного и того же вещества с противоположными
знаками вращения имеют зеркально-противоположные конфигурации. Одинаковый
знак вращения разных веществ не служит доказательством сходства их конфигураций,
а вещества с противоположным знаком вращения могут иметь одинаковые конфигурации,
как, напр., левовращающая молочная к-та и её правовращающие эфиры.
геветич. связи веществ применяют знаки L и D, показывающие конфигурационное
родство определённого оптически активного вещества с L-или D-глицериновым
альдегидом или соответственно с L-или D-глюкозой. Левовращающая молочная
к-та оказывается принадлежащей к D-ряду и обозначается как D-(-)-молочная
к-та, правовращающая - к L-ряду и обозначается как L-( + )-молочная к-та.
количеств оптич. антиподов ведёт себя как индивидуальное хим. соединение,
лишённое оптич. активности и сильно отличающееся по физ. свойствам от каждого
из антиподов. Такое вещество наз. рацемическим соединением, или рацематом
[d,l- или (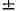 )-форма]. При всех
)-форма]. При всех
химич. превращениях, при к-рых образуются новые асимметрич. атомы углерода,
всегда получаются рацематы, т. к. вероятности образования правовращающей
и левовращающей форм равны.
типа abcC'- -C"def, содержащих два асимметрич. центра, возможны следующие
четыре изомера соответственно конфигурации асимметрич. атомов С' и С":
левый - левый (I), левый - правый (II), правый- правый (III) и правый -
левый (IV):

и В обозначают соответственно атомы С' и С").
II и IV - оптич. антиподы. Формы I и II, I я IV, II и III не являются антиподами,
т.
к. конфигурации одного асимметрич. центра у них противоположны, а другого
совпадают. Такие оптич. изомеры наз. диастерео-изомерами, или диастереомерами.
Диа-стереомеры резко различаются по всем важнейшим физ. свойствам. Если
же заместители при двух асимметрич. центрах одинаковы, т. е. в случае соединений
типа abc-С'-С"-abc [напр., винные кислоты HOOCCH(OH)CH(OH)COOH], формы
II и IV совпадут и дадут оптически недеятельную форму (лезо-форму), т.
к. оптич. активность одного центра (C') компенсируется равной по величине
и противоположной по знаку активностью др. центра (C").
могут быть расщеплены на оптич. антиподы. Для этого обычно используют реакции
с оптически активными веществами.
важнейшую роль в биологич. процессах. Оптически активными являются природные
аминокислоты, углеводы, алкалоиды и др.
соединений тесно связана с геометрич. И.; так, mpowc-форма дизамещённого
циклического соединения (напр., XXXIII) не совпадает со своим зеркальным
отображением.
можно определить относит, конфигурацию вещества, т. е. принадлежность его
к D- или Z-ряду. Вопрос же об абс. конфигурации, т. е. о действительном
расположении заместителей в пространстве вокруг асимметрич. центра, решается
физ. методами - на основании данных дисперсии оптич. вращения и рентгеноструктурного
анализа. Оптич. И. может быть обусловлена не только наличием асимметрич.
атомов, но и асимметрией молекулы в целом, как, напр., у замещённых алленов
и спиранов:
дифенила, имеющих объёмистые заместители в орто-положении, возможно существование
оптич. изомеров вследствие затруднённости вращения бензольных колец:
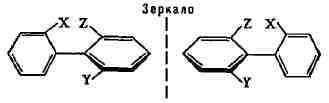
оптич. изомерии наз. атропоизомерией (по существу, это частный случай поворотной
И.). Поворотная И. обусловлена ограниченным вращением в молекуле атомов
или групп атомов вокруг углерод-углеродной (или любой другой) простой связи.
Геометрич. формы, к-рые принимает при этом молекула, наз. конформация-м
и, а соответствующие структуры - конформерами (конформацион-ными, вращательными,
или поворотными изомерами). Существование предпочтительных конформаций
связано с взаимодействием валентно не связанных между собой атомов и групп
атомов. Теоретически молекула может принимать бесчисленное множество конформаций,
однако реализуются обычно немногие, выгодные энергетически. Напр., из всех
возможных конформаций этана энергетически наиболее выгодна заторможённая
конфор-мация (а), наименее - заслонённая (б):
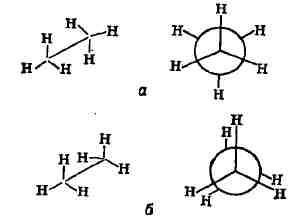
конформация обладает минимальной энергией, заслонённая - максимальной;
у большинства соединений устойчивыми формами являются заторможённые конформации).
Разность энергий между конформациями а у. 6 составляет 11,7 кдж/моль (2,8ккал/моль);
это энергетический барьер вращения вокруг связи С-С в этане, т. е. энергия,
необходимая для перехода из одной устойчивой (заторможённой) конформации
в другую. При вращении групп СН
все три устойчивые конформации идентичны. Для замещённых этанов, напр,
для 1,2-дихлорэтана, они уже не все равноценны (возможны две заторможённые
конформации и одна заслонённая). Так, тран-соидная конформация (в) выгоднее
скошенной, или гош-конформации (г), на 5,02 кдж/моль (1,2 ккал/моль), разность
же между энергиями трансоидной (в) и заслонённой (5) конформации составляет
20,93 кдж/моль (5 ккал/моль):
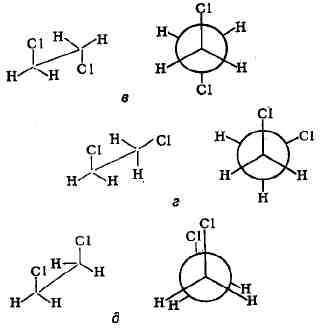
рассмотренного выше случая атропоизомерии, энергетич. барьеры конформационных
переходов недостаточно велики, чтобы поворотные изомеры можно было выделить,
однако их можно наблюдать, напр., методами инфракрасной спектроскопии и
особенно ядерного магнитного резонанса (часто только при пониженной темп-ре).
Исследование конформационных состояний имеет большое значение при изучении
физико-хим. свойств веществ и их реакционной способности. См. Конформа-ционный
анализ.
Э., Стереохимия соединений углерода, пер. с англ., M., 1965; Te-рентьев
А. П., Потапов В. M-, Основы стереохимии, M.- Л., 1964.