ЖИДКОСТЬ
агрегатное
состояние вещества, промежуточное между твёрдым и газообразным состояниями.
Ж., сохраняя отд. черты как твёрдого тела, так и газа, обладает, однако,
рядом только ей присущих особенностей, из к-рых наиболее характерная -
текучесть.
Подобно
твёрдому телу, Ж. сохраняет свой объём, имеет свободную поверхность, обладает
определённой прочностью на разрыв при всестороннем растяжении и т. д. С
другой стороны, взятая в достаточном количестве Ж. принимает форму сосуда,
в к-ром находится. Принципиальная возможность непрерывного перехода Ж.
в газ также свидетельствует о близости жидкого и газообразного состояний.
По хим. составу различают
однокомпонентные, или чистые, Ж. и двух- или многокомпонентные
жидкие смеси (растворы). По физ. природе Ж. делятся на нормальные
(обычные), жидкие кристаллы с сильно выраженной анизотропией (зависимостью
свойств от направления) и квантовые жидкости - жидкие 4Не,
3Не
и их смеси - со специфич. квантовыми свойствами при очень низких темп-pax.
Нормальные чистые Ж. имеют только одну жидкую фазу
(т. е. существует
один единственный вид каждой нормальной Ж.). Гелий
4Не может
находиться в двух жидких фазах - нормальной и сверхтекучей, а жидкокристаллич.
вещества - в нормальной и одной или даже двух анизотропных фазах.
Общим для всех нормальных
Т. о., при нагревании или
Малое различие этих теплоёмкостей
Фазовое состояние вещества
Вид радиальной функции распределения
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
Ж., в т. ч. и для смесей, является их макроскопич. однородность В Изотропность
при отсутствии внешних воздействий. Эти свойства сближают Ж. с газами,
но резко отличают их от анизотропных кристаллич. твёрдых тел. Аморфные
твёрдые тела (напр., стёкла), с совр. точки зрения, являются переохлаждёнными
Ж. (см. Аморфное состояние) и отличаются от обычных Ж. только численными
значениями кинетич. характеристик (существенно большей вязкостью и др.).
Область существования нормальной жидкой фазы ограничена со стороны низких
темп-р фазовым переходом в твёрдое состояние-. кристаллизацией или
(в зависимости от величины приложенного давления) фазовым переходом в сверхтекучее
состояние для 4Не и в жидко-анизотропное состояние для жидких
кристаллов. При давлениях ниже критич. давления р
жидкая фаза ограничена со стороны высоких темп-р фазовым переходом в газообразное
состояние - испарением. При давлениях р>р
переход отсутствует и по своим физ. свойствам Ж. в этой области неотличима
от плотного газа. Наивысшая темп-pa Т
возможен фазовый переход Ж.- газ, называется критической. Значения р
Т
тождественными. Наличие критич. точки для фазового перехода Ж.- газ позволяет
осуществить непрерывный переход из жидкого состояния в газообразное, минуя
область, где газ и Ж. сосуществуют (см. Критическое состояние).
уменьшении плотности свойства Ж. (теплопроводность, вязкость, самодиффузия
и др.), как правило, меняются в сторону сближения со свойствами газов.
Вблизи же темп-ры кристаллизации большинство свойств нормальных Ж. (плотность,
сжимаемость, теплоёмкость, электропроводность и т. д.) близки к таким же
свойствам соответствующих твёрдых тел. В табл. приведены значения теплоёмкости
при постоянном давлении (с
жидком состояниях при темп-ре кристаллизации.
некоторых веществ [в дж/(кг*К)], при температуре кристаллизации
показывает, что тепловое движение в Ж. и твёрдых телах вблизи темп-ры кристаллизации
имеет примерно одинаковый характер.
Молекулярная теория Ж.
По
своей природе силы межмолекулярного взаимодействия в Ж. и кристаллах
одинаковы и имеют примерно одинаковые величины. Наличие в Ж. сильного межмолекулярного
взаимодействия обусловливает, в частности, существование
поверхностного
натяжения на границе Ж. с любой др. средой. Благодаря поверхностному
натяжению Ж. стремится принять такую форму, при к-рой её поверхность (при
данном объёме) минимальна. Небольшие объёмы Ж. имеют обычно характерную
форму капли. В отсутствии внешних сил, когда действуют только межмолекулярные
силы (напр., в условиях невесомости), Ж. приобретает форму шара.
Влияние поверхностного натяжения на равновесие и движение свободной поверхности
Ж., границ Ж. с твёрдыми телами или границ между несмешивающимися Ж. относится
к области капиллярных явлений.
зависит от физ. условий, в к-рых оно находится, гл. обр. от темп-ры Т
и
давления р. Характерной определяющей величиной является зависящее
от темп-ры и давления отношение е (Т, р) средней потенциальной
энергии взаимодействия молекул к их средней кинетич. энергии.
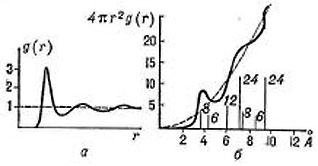
g(r)
для
жидкого натрия (в условных единицах): а