ДОНОРНО-АКЦЕПТОРНАЯ СВЯЗЬ
координационная
связь, термин, обозначающий один из способов образования химич. ковалентной
связи. Обычная ковалентная связь между двумя атомами обусловлена взаимодействием
двух электронов - по одному от каждого атома. Д.-а. с. осуществляется за
счёт пары электронов одного атома (д о н о-р а) и свободной (незаполненной)
орби-тали другого (акцептора). Схематически это различие можно выразить
так:
![]()
В обоих случаях электроны становятся общими
для двух атомов. Типичным примером является образование иона аммония пои
реакции аммиака с ионом водорода (протоном):
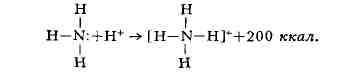
В молекуле аммиака азот имеет неподелённую
В данном случае молекула воды - донор,
Этот способ образования ковалентной связи
пару электронов, у иона водорода 1s-орбиталь свободна. При достаточном
сближении молекулы NH
облако азота попадает в сферу притяжения иона водорода и становится общим
и для атома азота, и для атома водорода, т. е. возникает четвёртая ковалентная
связь N - Н. Все связи N-Н в этом ионе становятся равноценными и неразличимыми.
Ещё один важный пример - образование иона оксония:
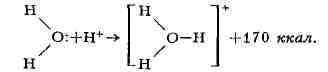
протон - акцептор.
играет большую роль в химии комплексных соединений.
А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Ъ Ы Ь Э Ю Я