ДИАГРАММА СОСТОЯНИЯ
диаграмма равновесия,
фазовая диаграмма, графическое изображение соотношений между параметрами
состояния физико-химич. системы (темп-рой, давлением и др.) и её составом.
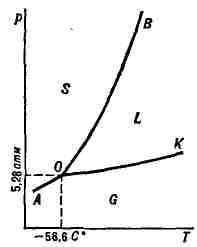
Диаграмма состояния двуокиси углерода СО В простейшем случае, когда система состоит
к-рым откладывают температуру (Т), давление
В качестве простейшего примера на рис.
Экспериментальное построение Д. с. осуществляется
Лит.: Аносов В. Я.,Погодине. А.,
С. А. Погодин.
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
только из одного компонента, Д. с. представляет собой трёхмерную пространственную
фигуру, построенную в трёх прямоугольных координатных осях, по
(р)
и
мольный объём (v). Пользование объёмной Д. с. неудобно вследствие
её громоздкости; поэтому на практике применяют проекцию Д. с. на одну из
координатных плоскостей, обычно на плоскость р - Т.
изображена (без соблюдения масштаба) Д. с. двуокиси углерода СО
отвечает равновесию трёх фаз - твёрдой, жидкой и газообразной СО
твёрдой и газообразной СО
газообразной G. Точка К отвечает критической температуре (31,0
°С), при к-рой исчезает различие между свойствами жидкости и газа. Согласно
терминологии фаз правила, точке О отвечает нонвариантное равновесие,
точкам на кривых ОА, ОВ и ОК - моновариантное равновесие,
а точкам на полях S, L и G - дивариантное равновесие. В случае полиморфизма
Д.
с. усложняется (число тройных точек равно числу полиморфных превращений).
О Д. с. систем, число компонентов к-рых больше 1, см. в статье Двойные
системы.
различными методами физико-химич. анализа, термич. и рент-генографич. анализов,
оптич. и электронной микроскопии, дилатометрии, измерения электросопротивления,
твёрдости и др. свойств. Правильность построения Д. с. проверяется на основании
правила фаз, принципа соответствия и принципа непрерывности. Д. с. широко
применяют на практике в металловедении, металлургии, химии и др.; напр.,
Д. с. железо - углерод имеет важное значение для термич. обработки стали.
Основные начала физико-химического анализа, М.- Л., 1947; Аносов В. Я.,
Краткое введение в физико-химический анализ, М., 1959; Древинг В. П., Калашников
Я. А., Правило фаз с изложением основ термодинамики, 2 изд., М.. 1964.