Согласно молекулярно-кинетич. теории строения вещества, Д.- Т. э. свидетельствует о наличии в газе сил межмолекулярного взаимодействия (обнаружение этих сил было целью опытов Джоуля и Томсона). Действительно, при взаимном притяжении молекул внутр. энергия (U
Согласно молекулярно-кинетич. теории строения вещества, Д.- Т. э. свидетельствует о наличии в газе сил межмолекулярного взаимодействия (обнаружение этих сил было целью опытов Джоуля и Томсона). Действительно, при взаимном притяжении молекул внутр. энергия (U
ДЖОУЛЯ-ЛЕНЦА ЗАКОН
Согласно молекулярно-кинетич. теории строения вещества, Д.- Т. э. свидетельствует о наличии в газе сил межмолекулярного взаимодействия (обнаружение этих сил было целью опытов Джоуля и Томсона). Действительно, при взаимном притяжении молекул внутр. энергия (U
i>)
Величина и знак Д. - Т. э. определяются
Для идеального газа, молекулы к-рого рассматриваются
В зависимости от условий дросселирования
Рис. 2. Кривая инверсии азота. В пределах
Значения верхних темп-р инверсии (Т Д.- Т. э., характеризуемый малыми значениями
Лит.: Ландау Л. Д., Ахиезер А. И.,
И. А. Яковлев.
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
газа включает как кинетическую энергию молекул, так и потенциальную энергию
их взаимодействия. Расширение газа в условиях энергетич. изоляции не меняет
его внутр. энергии, но приводит к росту потенциальной энергии взаимодействия
молекул (поскольку расстояния между ними увеличиваются) за счёт кинетической.
В результате тепловое движение молекул замедлится, темп-pa расширяющегося
газа будет понижаться. В действительности процессы, приводящие к Д.- Т.
э., сложнее, т. к. газ не изолирован энергетически от внеш. среды. Он совершает
внеш. работу (последующие порции газа, справа от дросселя, теснят предыдущие),
а слева от дросселя над самим газом совершают работу силы внеш. давления
(поддерживающие стационарность потока). Это учитывается при составлении
энергетич. баланса в опытах Джоуля-Томсона. Работа продавливания через
дроссель порции газа, занимающей до дросселя объём V
же порция газа, занимая за дросселем объём V
быть как положит., так и отрицат. В адиабатич. условиях она может пойти
только на изменение внутр. энергии газа: A =U
зная уравнение состояния газа и выражение для U, можно найти ДТ.
соотношением между работой газа и работой сил внеш. давления, а также свойствами
самого газа, в частности размером его молекул.
как материальные точки, не взаимодействующие между собой, Д.- Т. э. равен
нулю.
один и тот же газ может как нагреваться, так и охлаждаться. Темп-pa, при
к-рой (для данного давления) разность ДТ проходя через нулевое значение,
меняет свой знак, называется температурой инверсии Д.-Т. э. Типичная кривая
зависимости темп-ры инверсии от давления показана на рис. 2. Кривая инверсии
отделяет совокупность состояний газа, при переходе между к-рыми он охлаждается,
от состояний, между к-рыми он нагревается.
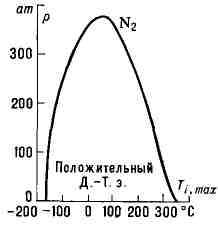
кривой эффект Джоуля - Томсона положителен (ДТ<0), вне кривой -
отрицателен (ДТ>0). Для точек на самой
кривой эффект равен нулю.
ДТ при малых перепадах давления Др, называют дифференциальным. При больших
перепадах давления на дросселе темп-pa газа может изменяться значительно.
Напр., при дросселировании от 200 до 1 атмосферы и начальной темп-ре 17
°С воздух охлаждается на 35 °С. Этот интегральный эффект положен в основу
большинства технич. процессов сжижения газов.
Лифшиц Е. М., Курс общей физики. Механика и молекулярная физика, М., 1965;
Ландау Л. Д., Лифшиц Е. М., Статистическая физика, М., 1964 (Теоретическая
физика, т. 5); Зоммерфельд А., Термодинамика и статистическая физика, пер.
с нем., М., 1955; Леонтович М. А., Введение в термодинамику, 2 изд., М.-Л.,
1952.