ДЕЙСТВУЮЩИХ МАСС ЗАКОН
один из
осн. законов физической химии; устанавливает зависимость скорости хим.
реакции от концентраций реагирующих веществ и соотношение между концентрациями
(или активностями) продуктов реакции и исходных веществ в состоянии хим.
равновесия. Норв. учёные К. Гульдберг и П. Вааге, сформулировавшие Д. м.
з. в 1864-67, назвали "действующей массой" вещества его количество в единице
объёма, т. е. концентрацию, отсюда - наименование закона.
Если в идеальной газовой смеси или идеальном
Скорость реакции (1) в обратном направлении
r где К = k где РА - парциальное давление вещества
Уравнения (2) и (3) применимы к простой
Общим условием равновесия по отношению
в к-ром [А] - активность вещества
Лит. см. при ст. Кинетика химическая
М. И. Тёмкин.
жидком растворе происходит реакция:
аА + а'А' = bВ +
b'В'
(1)
(А,А' и т. д.- вещества, а, а' к т.
д.-стехиометрические коэффициенты), то, согласно Д. м. з., скорость реакции
в прямом направлении: r
(2) Здесь [А] - концентрация вещества А и т. д., k+ - константа
скорости реакции (в прямом направлении). k
темп-ры, а в случае жидкого раствора -также и от давления; последняя зависимость
существенна лишь при высоких давлениях. Вид уравнения (2) определяется
тем, что необходимым условием элементарного акта реакции является столкновение
молекул исходных веществ, т. е. их встреча в нек-ром малом объёме (порядка
размера молекул). Вероятность найти в данный момент в данном малом объёме
молекулу А пропорциональна [А]; вероятность найти в нём одновременно а
молекул
А и а' молекул А' по теореме о вероятности сложного события пропорциональна
[А]a [А']a'. Число столкновений молекул исходных
веществ в единичном объёме за единичное время пропорционально этой величине.
Определённая доля этих столкновений приводит к реакции. Отсюда вытекает
уравнение (2). Мономолекулярные реакции требуют особого рассмотрения.
[В']b'. (3) Если реакция обратима, т. е. протекает одновременно
в противоположных направлениях, то наблюдаемая скорость реакции r =
r![]()
уравнение
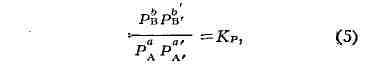
А и т. д.
(одностадийной) реакции и к отд. стадиям сложной реакции, но не к сложной
реакции в целом. Уравнения (4) и (5), выражающие Д. м. з. для равновесия,
справедливы и в случае сложной реакции.
к реакции (1), приложимость к-рого не ограничена идеальными системами,
является уравнение
![]()
А и т. д. Уравнение (6) выводится из принципов термодинамики. С помощью
Д. м. з. для равновесия вычисляют максимально достижимые степени превращения
при обратимых реакциях. В число последних входят важные пром. процессы
-синтез аммиака, окисление сернистого газа и многие другие. На основе Д.
м. з. для скоростей реакций получают кинетич. уравнения, применяемые при
расчёте хим. аппаратуры.
и
Термодинамики
химическая.
А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Ъ Ы Ь Э Ю Я