ДВОЙНАЯ СВЯЗЬ
ковалентная четырёхэлектронная
связь между двумя соседними атомами в молекуле. Д. с. обычно обозначается
двумя валентными штрихами: >С = С<, >C = N -, >С = О, >C = S,-N = N-<,
-N
= O и дp. При этом подразумевается, что одна пара электронов с sp2-
или
sp-гибридизованными орбиталями образует о-связь (см. рис. 1), электронная
плотность которой сосредоточена вдоль межатомной оси; о-связь подобна простой
связи. Другая пара электронов с р-орбиталями образует я-связь, электронная
плотность к-рой сосредоточена вне межатомной оси. Если в образовании Д.
с. принимают участие атомы IV или V группы периодич. системы, то эти атомы
и атомы, связанные с ними непосредственно, расположены в одной плоскости;
валентные углы равны 120°.
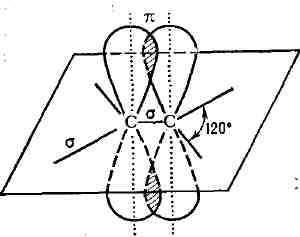
Рис. 1. Схема двойной связи >С = С<
В случае несимметричных систем возможны
искажения молекулярной структуры. Д. с. короче простой связи и характеризуется
высоким энергетич. барьером внутр. вращения; поэтому положения заместителей
при атомах, связанных Д. с., неэквивалентны, и это обусловливает явление
геометрия, изомерии. Соединения, содержащие Д. с., способны к реакциям
присоединения. Если Д. с. электронно-симметрична, то реакции осуществляются
как по радикальному (путём гомолиза я-связи), так и по ионному механизмам
(вследствие поляризующего действия среды). Если электроотрицательности
атомов, связанных Д. с., различны или если с ними связаны различные заместители,
то я-связь сильно поляризована. Соединения, содержащие полярную Д. с.,
склонны к присоединению по ионному механизму: к элект-роноакцепторной Д.
с. легко присоединяются нуклеофильные реагенты, а к электронодонорной Д.
с. - электро-фильные. Направление смещения электронов при поляризации Д.
с. принято указывать стрелками в формулах, а образующиеся избыточные заряды-символами
б- и б+. Это облегчает понимание радикального и ионного
механизмов реакций присоединения:
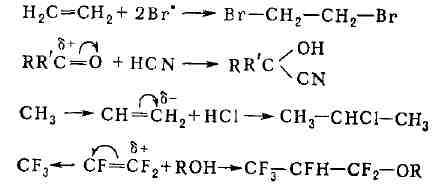
В соединениях с двумя Д. с., разделёнными
одной простой связью, имеет место сопряжение л-связей и образование
единого я-электронного облака, лабильность которого проявляется
вдоль всей цепи (рис. 2, слева). Следствием такого сопряжения
является способность к реакциям 1,4-присоединения:
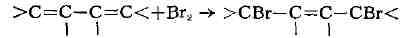
Если три Д. с. сопряжены в шестичлен-ном
цикле, то секстет я-электронов становится общим для всего цикла и образуется
относительно стабильная ароматич. система (см. рис. 2, справа).
Присоединение к подобным соединениям как электрофильных, так и нуклеофильных
реагентов энергетически затруднено. (См. также Химическая связь.)
Рис. 2. Системы сопряжённых связей
(вид сверху).
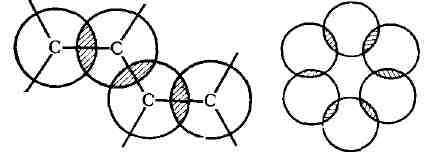
Г. А. Сокольский.
А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Ъ Ы Ь Э Ю Я