ГЕЙ-ЛЮССАКА ЗАКОНЫ
открытые
Ж. Л. Гей-Люссаком в нач. 19 в. законы, описывающие нек-рые свойства газов.
1) 3акон теплового расширения
газов утверждает, что изменение объёма данной массы газа при постоянном
давлении прямо пропорционально изменению темп-ры
2) Закон объёмных отношений
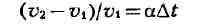 или
или 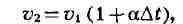 где
где
v
а - коэфф. теплового расширения газов при постоянном давлении. Величина
а для всех газов при нормальных условиях приблизительно одинакова и при
измерении темп-ры газа в °Са = 1/273,15 (или 0,00367). Сочетая этот закон
с законом Бойля- Мариотта, Э. Клапейрон вывел уравнение состояния идеального
газа, связывающее р, v и Т (см. Клапейрона уравнение).
гласит, что объёмы газов, вступающих в химич. реакцию, находятся в простых
отношениях друг к другу и к объёмам газообразных продуктов реакции. Другим
и словам и, отношение объёмов, в к-рых газы участвуют в реакции, соответствует
отношению небольших целых чисел. Измеряя при одинаковых условиях объёмы
водорода, хлора и хлористого водорода, Гей-Люссак нашёл, что один объём
водорода и один объём хлора, соединяясь, дают два объёма хлористого водорода,
т. е. отношение объёмов равно 1:1:2. Сходная картина имеет место и при
других реакциях с участием газов. Этот закон сыграл важную роль в создании
атомно-молекулярной теории. Он послужил толчком для открытия Аво-гадро
закона, с помощью к-рого Авогадро впервые сделал правильный вывод о составе
молекул простых газов (Н
всех газов точно известны, отыскание отношения объёмов газов, вступающих
между собой в реакцию, уже не требует сложных измерений. Так, из уравнения
синтеза хлористого водорода из водорода и хлора Н
А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Ъ Ы Ь Э Ю Я