ГАЗЫ
(франц. gaz;
назв. предложено голл. учёным Я. Б. Гельмонтом), агрегатное состояние
вещества, в к-ром его частицы не связаны или весьма слабо связаны силами
взаимодействия и движутся свободно, заполняя весь предоставленный им объём.
Вещество в газообразном состоянии широко распространено в природе. Г. образуют
атмосферу Земли, в значит, количествах содержатся в твёрдых земных породах,
растворены в воде океанов, морей и рек. Солнце, звёзды, облака межзвёздного
вещества состоят из Г.- нейтральных или ионизованных (плазмы). Встречающиеся
в природных условиях Г. представляют собой, как правило, смеси химически
индивидуальных Г.
|
Физические
свойства газов |
||||||
|
Свойства
газа |
Азот
N |
Аргон
Аr |
Водород
Н |
Воздух
|
Кислород
O |
Углекислый
газ СО |
|
Масса
1 моля (г) |
28,02
|
39,94
|
2,016
|
28,96
|
32,00
|
44,00
|
|
Плотность
при 0°С и 1 am* (кг/м3) |
1,2506
|
1,7839
|
0,0899
|
1
,2928 |
1,4290
|
1,976
|
|
Теплоёмкость
при постоянном объёме Сv и 0°С (кдж/моль*град) |
20,85
|
12,48
|
20,35
|
20,81
|
20,89
|
30.62
(55°С) |
|
Скорость
звука при 0°С (м/сек) |
333,6
|
319
|
1286
|
331,5
|
314,8
|
260,3
|
|
Вязкость
л при 00С (n* 106 н*сек/м2) |
16,6
|
21,2
|
8,4
|
17,1
|
19,2
|
13,8
|
|
Теплопроводность
ламбда при 0°С (лямбда*102 дж/м*сек* град) |
2,43
|
1,62
|
16,84
|
2,41
|
2,44
|
1,45
|
|
Диэлектрич.
проницаемость эпсилон при 0°С и 1 am* |
1,000588
|
1,000536
|
1,000272
|
1,000590
|
1,000531
|
1
,000988 |
|
Удельная
магнитная восприимчивость х при 20°С (капа*106 на 1 г) |
-0,43
|
-0,49
|
-1,99
|
-
|
+
107,8 |
-0,48
|
|
*
1 am = 9,81*104 н/м2. |
||||||
Г. обладают рядом характерных
свойств. Они полностью заполняют сосуд,< в к-ром находятся, и принимают
его форму. В отличие от твёрдых тел и жидкостей, объём Г. существенно зависит
от давления и темп-ры. Коэфф. объёмного расширения Г. в обычных условиях
(О-100°С) на два порядка выше, чем у жидкостей, и составляет в среднем
0,003663 град-1. В табл. приведены данные о физич. свойствах
наиболее распространённых Г.
Любое вещество можно перевести
Рис. 1. р, T-диаграмма состояния
При темп-рах ниже Т При Т>Т В связи с тем что область
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
в газообразное состояние надлежащим подбором давления и темп-ры. Поэтому
возможную область существования газообразного состояния графически удобно
изобразить в переменных: давление р - темп-pa Т (в р,
Т-диаграмме, рис. 1). При темп-рах ниже критической Т
Критическое
состояние) эта область ограничена кривыми сублимации
(возгонки)
I и парообразования II. Это означает, что при любом давлении
ниже критического р
Т (см.
рис. 1), определяемая кривой сублимации или парообразования, выше к-рой
вещество становится газообразным. В состояниях на
кривой I (ниже тройной точки Т
с твёрдым веществом (твёрдой фазой), а на кривой II (между тройной и критич.
точкой K) - с жидкой фазой. Газ в этих состояниях обычно называют паром
вещества.
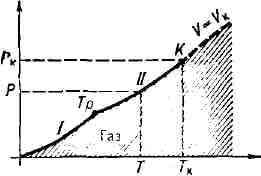
вещества. Область газообразного состояния заштрихована. Со стороны низких
температур и давлений она ограничена кривыми сублимации (I) и парообразования
(II). Тр - тройная точка, К - критическая точка. Штриховой линией показана
критическая изохора вещества.
сконденсировать Г.- перевести его в др. агрегатное состояние (твёрдое или
жидкое). При этом фазовое превращение Г. в жидкость или твёрдое
тело происходит скачкообразно: весьма малое изменение давления приводит
к конечному изменению ряда свойств вещества (напр., плотности,
энтальпии,
теплоёмкости и др.). Процессы конденсации Г., особенно сжижение
газов, имеют важное техническое значение.
газообразной области условна, поскольку при этих темп-рах фазовые превращения
не происходят. В ряде случаев за условную границу между Г. и жидкостью
при сверхкритич. темп-pax и давлениях принимают критич. изохору вещества
(кривую постоянной плотности или удельного объёма, см, рис. 1),
в непосредств. близости от к-рой свойства вещества изменяются, хотя и не
скачком, но особенно быстро.
газового состояния очень обширна, свойства Г. при изменении темп-ры и давления
могут меняться в широких пределах. Так, в нормальных условиях (при 0°С
и атмосферном давлении) плотность Г. примерно в 1000 раз меньше плотности
того же вещества в твёрдом или жидком состоянии. При комнатной темп-ре,
но давлении, в 1017 раз меньшем атмосферного (предел, достигнутый
совр. вакуумной техникой), плотность Г. составляет ок. 10-20г/см3.
В космич. условиях плотность Г. может быть ещё на 10 порядков меньше (