ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
принцип,
устанавливающий необратимость макроскопич. процессов, протекающих с конечной
скоростью. В отличие от чисто механических (без трения) или электродинамических
(без выделения джоулевой теплоты) обратимых процессов, процессы,
связанные с теплообменом при конечной разности темп-р (т. е. текущие с
конечной скоростью), с трением, диффузией газов, расширением газов в пустоту,
выделением джоу левой теплоты и т. д., необратимы, т. е. могут самопроизвольно
протекать только в одном направлении (см. Необратимые процессы).
Исторически В. н. т. возникло из анализа
работы тепловых машин (С. Карно, 1824). Существует неск. эквивалентных
формулировок В. н. т. Само назв. "В. н. т." и исторически первая его формулировка
(1850) принадлежат Р. Клаузиусу: невозможен процесс, при к-ром теплота
переходила бы самопроизвольно от тел более холодных к телам более нагретым.
При этом самопроизвольный переход не следует понимать в узком смысле: невозможен
не только непосредств. переход, его невозможно осуществить и с помощью
машин или приборов без того, чтобы в природе не произошло ещё к.-л. изменений.
Иными словами, невозможно провести процесс, единств, следствием к-рого
был бы переход теплоты от более холодного тела к более нагретому. Если
бы (в нарушение положения Клаузиуса) такой процесс оказался возможным,
то можно было бы, разделив один тепловой резервуар на 2 части и переводя
теплоту из одной в другую, получить 2 резервуара с различными темп-рами.
Это позволило бы, в свою очередь, осуществить Карно цикл и получить
механич. работу с помощью периодически действующей (т. е. многократно возвращающейся
к исходному состоянию) машины за счёт внутренней энергии одного
теплового резервуара. Поскольку это невозможно, в природе невозможны процессы,
единств, следствием к-рых был бы подъём груза (т. е. механич. работа),
произведённый за счёт охлаждения теплового резервуара (такова формулировка
В. н. т., данная У. Томсоном, 1851). Обратно, если бы можно было
получить механич. работу за счёт внутр. энергии одного теплового резервуара
(в противоречии с В. н. т. по Томсону), то можно было бы нарушить и положение
Клаузиуса. Механич. работу, полученную за счёт теплоты от более холодного
резервуара, можно было бы использовать для нагревания более тёплого резервуара
(напр., трением) и тем самым осуществить переход теплоты от холодного тела
к нагретому. Обе приведённые формулировки В. н. т., являясь эквивалентными,
подчёркивают существ, различие в возможности реализации энергии, полученной
за счёт внеш. источников работы, и энергии беспорядочного (теплового) движения
частиц тела.
Возможность использования энергии теплового
движения частиц тела (теплового резервуара) для получения механич. работы
(без изменения состояния др. тел) означала бы возможность реализации т.
н. вечного двигателя 2-го рода, работа к-рого не противоречила бы
закону сохранения энергии. Так, работа двигателя корабля за счёт охлаждения
забортной воды океана - доступного и практически неисчерпаемого резервуара
внутр. энергии - не противоречит закону сохранения энергии, но если, кроме
охлаждения воды, нигде других изменений нет, то работа такого двигателя
противоречит В. н. т. В реальном тепловом двигателе процесс превращения
теплоты в работу обязательно сопряжён с передачей определённого количества
теплоты внеш. среде. В результате тепловой резервуар двигателя охлаждается,
а более холодная внеш. среда нагревается, что находится в согласии со В.
н. т. Следовательно, В. н. т. можно формулировать и как невозможность вечного
двигателя 2-го рода. Г. А. Зисман. В совр. термодинамике В. н. т.
формулируется единым и самым общим образом как закон возрастания особой
функции состояния системы, к-рую Клаузиус назвал энтропией (обозначается
S). Согласно этому закону, в замкнутой системе энтропия S при любом реальном
процессе либо возрастает, либо остаётся неизменной, т. е. изменение энтропии
бS>=0; знак равенства имеет место для обратимых процессов. В состоянии
равновесия энтропия замкнутой системы достигает максимума и никакие макроскопич.
процессы в такой системе, согласно В. н. т., невозможны. Для незамкнутой
системы направление возможных процессов, а также условия равновесия могут
быть получены из закона возрастания энтропии, применённого к составной
замкнутой системе, получаемой путём присоединения всех тел, участвующих
в процессе. Это приводит в общем случае необратимых процессов к неравенствам
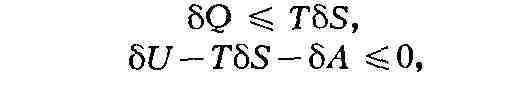
где бQ - переданное системе количество
теплоты, бА - совершённая над ней работа, бU - изменение её внутр.
энергии, Т - абс. темп-pa; знак равенства относится к обратимым
процессам.
Важные следствия даёт применение В. н.
т. к системам, находящимся в фиксированных внеш. условиях. Напр., для систем
с фиксированной темп-рой и объёмом неравенство (1') приобретает вид бF<=O,
где F = U-TS - свободная энергия системы. Т. о., в этих условиях
направление реальных процессов определяется убыванием свободной энергии,
а состояние равновесия - минимумом этой величины (см. Потенциалы термодинамические).
Приведённые в начале статьи формулировки
В. н. т. являются частным следствием общего закона возрастания энтропии.
В. н. т., несмотря на свою общность, не
имеет абс. характера, и отклонения от него (флуктуации) являются
вполне закономерными. Примерами таких флуктуационных процессов являются
броуновское
движение тяжёлых частиц, равновесное тепловое излучение
нагретых
тел (в том числе радиошумы), возникновение зародышей новой фазы при фазовых
переходах, самопроизвольные флуктуации темп-ры и давления в равновесной
системе и т. д.
Статистическая физика, построенная
на анализе микроскопич. механизма явлений, происходящих в макроскопич.
телах, и выяснившая физ. сущность энтропии, позволила понять природу В.
н. т., определить пределы его применимости и устранить кажущееся противоречие
между механич. обратимостью любого, сколь угодно сложного микроскопич.
процесса и термодинамич. необратимостью процессов в макротелах.
Как показывает статистич. термодинамика
(Л. Болъцман, Дж. Гиббс), энтропия системы связана со статистическим
весом Р макроскопич. состояния: S=klnP(k - Болъцмана постоянная).
Статистич.
вес Р пропорционален числу различных микроскопич. реализаций данного состояния
макроскопич. системы (напр., различных распределений значений координат
и импульсов молекул газа, отвечающих определённому значению энергии, давления
и др. термодинамич. параметров газа), т. е. характеризует как бы степень
неточности микроскопич. описания макросостояния. Для замкнутой системы
вероятность термодинамическая W данного макросостояния пропорциональна
его статистич. весу и определяется энтропией системы: W
А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Ъ Ы Ь Э Ю Я