ВАН-ДЕР-ВААЛЬСА УРАВНЕНИЕ
одно из первых уравнений состояния реального газа, предложенное
голландским физиком Я. Д. Ван-дер-Ваальсом (1873):
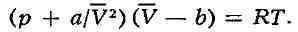
Здесь: р
- давление газа; Т - его температура;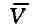 -
-
объём одного моля вещества; R - универсальная газовая
постоянная; a и b - константы, учитывающие отклонение свойств реального
газа от свойств идеального. Член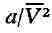
, имеющий размерность давления, учитывает притяжение между молекулами газа
за счёт ван-дер-ваальсовых сил (см. Межмолекулярное взаимодействие).
Константа b является поправкой на собственный объём молекул
газа и учитывает отталкивание молекул на близких расстояниях. Константы
а и bобычно определяются из экспериментальных данных. При больших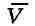 можно
можно
пренебречь обеими поправками и В. у. переходит в уравнение состояния идеального
газа (см. Клапейрона уравнение).
В. у. является
приближённым и количественно описывает свойства реальных газов лишь в области
высоких темп-р и низких давлений. Однако качественно
Диаграмма состояния
оно позволяет
На рис. изображено
Лит.: Штрауф
А. А. Лопаткин.
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
вещества в координатах объём - давление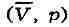
: T
рассчитанные по уравнению Ван-дер-Ваальса; К - критическая точка.
Линия dke ("спинодаль")очерчивает область неустойчивых состояний.
описывать поведение газа при высоких давлениях, конденсацию газа в жидкостей
критическое состояние (см. также Уравнение состояния).
семейство изотерм (кривых зависимости р от при
при
постоянной темп-ре), рассчитанных по В. у. Это уравнение, кубическое относительно ,
,
имеет три корня. При низких темп-рах все три корня - действительные, а
выше определённой темп-ры Т
лишь один действит. корень. Физически это означает, что при Т > Т
может находиться лишь в одном (газообразном) состоянии, а ниже Т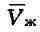
и газообразном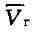
- и одном нестабильном). Графически это выражается так: при T<Т
объёмов. Точки прямой ас отвечают равновесию жидкости и её насыщенного
пара. В условиях равновесия, напр, в состоянии, соответствующем точке b,
относит, количества жидкости и пара определяются отношением отрезков
bс/bа ("правило моментов"). Равновесию фаз при определённой темп-ре
соответствуют давление насыщенного пара р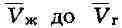 .
.
При более низких давлениях (правее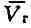 )
)
изотерма характеризует свойства газа. Левая, почти вертикальная часть изотермы
отражает очень малую сжимаемость жидкости. Участки ad и ес относятся
соответственно к перегретой жидкости и переохлаждённому пару (метастабильные
состояния). Участок ае физически неосуществим, т. к. здесь происходит
увеличение объёма при увеличении давления. Совокупность точек а, а',
а"... и с, с', с"... определяет кривую, наз. бинодалью, к-рая
очерчивает область совместного существования газа и жидкости. В крнтич.
точке К темп-pa, давление и объём (Т
у. ввести относит, величины: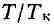 ,
,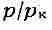
и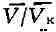 ,
,
то можно получить т. н. приведенное В. у., к-рое является универсальным,
т. е. не зависит от индивидуальных свойств вещества.
Е. А., Молекулярная физика. Л.- М., 1949; Зоммерфельд А., Термодинамика
и статистическая физика, пер. с нем., М., 1955: Вукалович М.П. и Новиков
И. И., Уравнение состояния реальных газов, М.- Л., 1948.