БУФЕРНЫЕ СИСТЕМЫ,
буферные растворы, буферные смеси, системы, поддерживающие определённую
Наоборот, при подщелачивании
По мере расходования
Кислотность растворов
3. Приливание того же
Б. с. широко используются
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
концентрацию ионов водорода Н+, т. е. определённую кислотность
среды. Кислотность буферных растворов почти не изменяется при их разбавлении
или при добавлении к ним нек-рых количеств кислот или оснований. Примером
Б. с. служит смесь растворов уксусной к-ты СНзСООН и её натриевой соли CH
е. даёт много ионов СН
сильной кислоты, дающей много ионов Н+, эти ионы связываются ионами СН
и образуют слабую (т. е. мало диссоциирующую) уксусную к-ту:
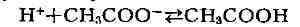
(1)
Б. с., т. е. при добавлении сильного основания (напр., NaOH), ионы ОН-
связываются Н+-ионами, имеющимися в Б. с. благодаря диссоциации
уксусной к-ты; при этом образуется очень слабый электролит - вода:
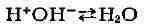
(2)
Н+-ионов на связывание и-онов ОН- диссоциируют всё новые
и новые молекулы СН
добавления ОН--ионов, эти ионы связываются и потому кислотность
раствора практически не меняется.
принято выражать т. н. водородным показателем рН (для нейтральных растворов
рН = 7, для кислых - рН меньше, а для щелочных - больше 7). Приливание к 1
л чистой воды 100 мл 0,01 молярного раствора НС1 (0,01 М) изменяет
рН от 7 до
раствора к 1 л Б. с. СНзСООН + CH
NaOH в чистой воде рН изменится от 7 до 11, а в указанной Б. с. лишь от 4,7
до 4,8. Кроме рассмотренного, имеются многочисленные другие Б. с. (примеры
см. в табл.). Кислотность (и, следовательно, рН) Б. с. зависит от природы
компонентов, их концентрации, а для нек-рых Б. с. и от темп-ры. Для каждой
Б. с. рН остаётся примерно постоянным лишь до определённого предела, зависящего
от концентрации компонентов.
буферных систем
(концентрации по 0,1 г*мол/л)
(при 15- 250С)
к-та + ацетат натрия, СН
натрий (дву-замещ.), C
к-та + бура, Н
к-та H- едкий натр, Н
натрия (двузамещ.)+ + едкий натр, Na
в аналитич. практике и в химич. произ-ве, т. к. многие химич. реакции идут
в нужном направлении и с достаточной скоростью лишь в узких пределах рН. Б.
с. имеют важнейшее значение для жизнедеятельности организмов; они определяют
постоянство кислотности различных биол. жидкостей (крови, лимфы, межклеточных
жидкостей). Основные Б. с. организма животных и человека: бикарбонатная (угольная
к-та и её соли), фосфатная (фосфорная к-та и её соли), белки (их буферные
свойства определяются наличием основных и кислотных групп). Белки крови (прежде
всего гемоглобин, обусловливающий ок. 75% буферной способности крови) обеспечивают
относительную устойчивость рН крови. У человека рН крови равен 7,35-7,47 и
сохраняется в этих пределах даже при значит, изменениях питания и др. условий.
Чтобы сдвинуть рН крови в щелочную сторону, необходимо добавить к ней в 40-70
раз больше щёлочи, чем к равному объёму чистой воды. Естественные Б. с. в
почве играют большую роль в сохранении плодородия полей. В. Л. Василевский.