БРОМ
(лат.
Bromum), Вг, химич. элемент VII группы периодич. системы Менделеева,
относится к галогенам; ат. н. 35, ат. масса 79,904; красно-бурая
жидкость с сильным неприятным запахом. Б. открыт в 1826 франц. химиком
А. Ж. Баларом при изучении рассолов средиземноморских соляных промыслов;
назван от греч.
bromos - зловоние. Природный Б. состоит из 2 стабильных изотопов 79Вr
(50,54%) и 81Вr (49,46%). Из искусственно полученных
радиоактивных изотопов Б. наиболее интересен 80Вr, на примере
к-рого И. В. Курчатовым открыто явление изомерии атомных ядер.
Нахождение
Физические
Конфигурация
Б.- сильный
соединениями
продукты перерабатывают
Вдыхание паров
Б. применяют
Лит.: Ксензенко
Бром в организме.
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
в природе. Содержание Б. в земной коре (1,6*10-4% по массе)
оценивается в 1015-1016т. В главной своей
массе Б. находится в рассеянном состоянии в магматич. породах, а также
в широко распространённых га-логенидах. Б.- постоянный спутник хлора. Бромистые
соли (NaBr, KBr, MgBr
- до 0.3% Вr), а также в морской воде (0,065% Вr), рапе соляных
озёр (до 0,2% Вr) и подземных рассолах, обычно связанных с соляными
и нефтяными месторождениями (до 0,1% Вr). Благодаря хорошей растворимости
в воде бромистые соли накопляются в остаточных рассолах морских и озёрных
водоёмов. Б. мигрирует в виде легко растворимых соединений, очень редко
образуя твёрдые минеральные формы, представленные бромиритом AgBr, эмболитом
Ag (Cl<, Вг) и иодэмболитом Ag (C1, Вr, I). Образование
минералов происходит в зонах окисления сульфидных серебро-содержащих месторождений,
формирующихся в засушливых пустынных областях. См. также Бромиды, природные.
и химические свойства. При - 7,20С жидкий Б. застывает, превращаясь
в красно-коричневые игольчатые кристаллы со слабым металлич. блеском. Пары
Б. жёлто-бурого цвета, t
Б. (при 200С) 3,1 г/см3. В воде
Б. растворим ограниченно, но лучше других галогенов (3,58 г Б. в
100 г Н
из воды осаждаются гранатово-красные кристаллы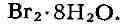
Особенно хорошо растворим Б. во многих органич. растворителях, чем пользуются
для извлечения его из водных растворов. Б. в твёрдом, жидком и газообразном
состоянии состоит из 2-атомных молекул. Заметная диссоциация на атомы начинается
при темп-ре ок. 8000С; диссоциация наблюдается и при действии
света.
внешних электронов атома Б. 4s2 4p5. Валентность
Б. в соединениях переменна, степень окисления равна - 1 (в бромидах, напр.
КВr), +1 (в гипобромитах, NaBrO), +3 (в бромитах, NaBrO
+5 (в броматах, КВrОз) и + 7 (в перброматах, NaBrO
Химически Б. весьма активен, занимая по реакционной способности место между
хлором и иодом. Взаимодействие Б. с серой, селеном, теллуром, фосфором,
мышьяком и сурьмой сопровождается сильным разогреванием, иногда даже появлением
пламени. Так же энергично Б. реагирует с нек-рыми металлами, напр, калием
и алюминием. Однако многие металлы реагируют с безводным Б. с трудом из-за
образования на их поверхности защитной плёнки бромида, нерастворимого в
Б. Из металлов наиболее устойчивы к действию Б., даже при повышенных темп-pax
и в присутствии влаги, серебро, свинец, платина и тантал (золото, в отличие
от платины, энергично реагирует с Б.). С кислородом, азотом и углеродом
Б. непосредственно не соединяется даже при повышенных темп-pax. Соединения
Б. с этими элементами получают косвенным путём. Таковы крайне непрочные
окислы Вr
Б. взаимодействует непосредственно, образуя BrF
окислитель. Так, он окисляет сульфиты и тиосульфаты в водных растворах
до сульфатов, нитриты до нитратов, аммиак до свободного азота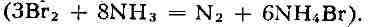
Б. вытесняет иод из его соединений, но сам вытесняется хлором и фтором.
Свободный Б. выделяется из водных растворов бромидов также под действием
сильных окислителей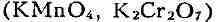
в кислой среде.
При растворении в воде Б. частич. родной кислоты НВг и неустойчивой бром-новатистой
кислоты НВгО. Раствор Б. в воде наз. бромной водой. При растворении
Б. в растворах щелочей на холоду
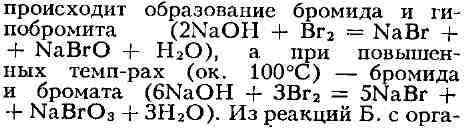 нич.
нич.
наиболее характерны присоединение по двойной связи С=С, а также замещение
водорода (обычно при действии катализаторов или света). Получение
и применение. Исходным сырьём для получения Б. служат морская вода, озёрные
и подземные рассолы и щелока калийного произ-ва, содержащие Б. в виде бромид-иона
Вr- (от 65 г/м3 в морской воде до 3-4 кг/м3
и выше в щелоках калийного произ-ва). Б. выделяют при помощи
хлора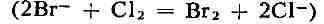
и отгоняют из раствора водяным паром или воздухом. Отгонку паром ведут
в колоннах, изготовленных из гранита, керамики или иного стойкого к Б.
материала. Сверху в колонну подают подогретый рассол, а снизу - хлор и
водяной пар. Пары Б., выходящие из колонны, конденсируют в керамиковых
холодильниках. Далее Б. отделяют от воды и очищают от примеси хлора дистилляцией.
Отгонка воздухом позволяет использовать для получения Б. рассолы с его
низким содержанием, выделять Б. из к-рых паровым способом в результате
большого расхода пара невыгодно. Из получаемой бромовоз душной смеси Б.
улавливают химич. поглотителями. Для этого применяют растворы бромистого
железа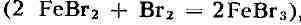
, к-рое, в свою очередь, получают восстановлением FeBr
сернистый ангидрид, реагирующий с Б. в присутствии паров
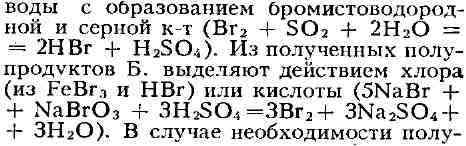
на бромистые соединения, не выделяя элементарного Б.
Б. при содержании их в воздухе 1 мг/м3 и более
вызывает кашель, насморк, носовое кровотечение, головокружение, головную
боль; при более высоких концентрациях - удушье, бронхит, иногда смерть.
Предельно допустимые концентрации паров Б. в воздухе 2 мг/м3.
Жидкий Б. действует на кожу,< вызывая плохо заживающие ожоги. Работы
с Б. следует проводить в вытяжных шкафах. При отравлении парами Б. рекомендуется
вдыхать аммиак, используя для этой цели сильно разбавленный раствор его
в воде или в этиловом спирте. Боль в горле, вызванную вдыханием паров Б.,
устраняют приёмом внутрь горячего молока. Б., попавший на кожу, смывают
большим количеством воды или сдувают сильной струёй воздуха. Обожжённые
места смазывают ланолином.
довольно широко. Он - исходный продукт для получения ряда бромистых солей
и органич. производных. Большие количества Б. расходуют для получения бромистого
этила и ди-бромэтана - составных частей этиловой жидкости, добавляемой
к бензинам для повышения их детонационной стойкости (см. Антидетонаторы).
Соединения Б. применяют в фотографии, при произ-ве ряда красителей,
бромистый метил и нек-рые другие соединения Б.- как инсектициды. Нек-рые
органич. соединения Б. служат эффективными огнетушаши-ми средствами. Б.
и бромную воду используют при химич. анализах для определения мн. веществ.
В медицине используют бромиды натрия, калия, аммония,< а также органич.
соединения Б., к-рые применяют при неврозах, истерии, повышенной раздражительности,
бессоннице, гипертонич. болезни, эпилепсии и хорее.
В. И., Стасиневич Д. С., Технология брома и иода, М., 1960; Позин М. Е..
Технология минеральных солей, 2 изд., Л., 1961; Bromine and its compounds,
ed. Z- E. Jolles, L., 1966. В. К. Бельский, Д. С. Стасиневич.
Б. - постоянная составная часть тканей животных и растений. Наземные растения
содержат в среднем 7*10-4% Б. на сырое вещество,< животные