БОЙЛЯ - МАРИОТТА ЗАКОН
один из
основных газовых законов, согласно к-рому при постоянной темп-ре объём
V
данной
массы идеального газа обратно пропорционален его давлению
р,
т.
е. pV = С = const (рис. 1). Постоянная С пропорциональна массе газа
(числу молей) и его абсолютной температуре.
Закон установлен по опытным данным англ,
учёным Р. Бойлем (1662) и независимо от него франц. учёным Э. Мариоттом
(1676).
Б.-М. з. следует из кинетич. теории газов,
если
принять, что размеры молекул пренебрежимо малы по сравнению с расстоянием
между ними и отсутствует межмолекулярное взаимодействие.
Иными словами,
Б.-М. з. выполняется строго для идеального газа.
Для реальных газов,
у к-рых влиянием размеров молекул и их взаимодействием пренебрегать нельзя,
Б. - М. з. выполняется приближённо (рис. 2), тем лучше, чем дальше от критического
состояния находится газ.
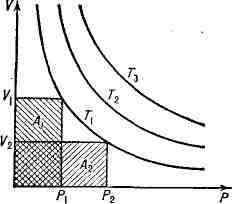
Рис. 1. Зависимость объёма V неизменной
Рис. 2. Отклонение поведения реальных
массы идеального газа от давления р при постоянной температуре Т. Изотермы
Т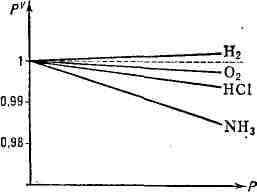
газов от закона Бойля - Мариотта. Пунктир соответствует линии pV=C
А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Ъ Ы Ь Э Ю Я