БОЙЛЯ ТОЧКА
точка минимума на изотерме
реального газа, изображённой в координатах р - pV (см. рис., р
- давление газа, V - занимаемый газом объем); названа по имени
англ, учёного Р. Бойля.
Вблизи Б. т. небольшие участки изотерм
реального газа можно приближённо рассматривать как отрезки горизонтальных
прямых, представляющих, согласно Клапейрона уравнению pV = mRT, изотермы
идеального газа (Т - абс. темп-ра R - газовая постоянная,
т
- масса газа). Иными словами, Б. т. определяетемп-ру, при к-рой для
данного реального газа применимо уравнение идеального газа. Участок изотермы
ab
(слева
от Б. т.) соответствует условиям, когда реальный газ более сжимаем, чем
идеальный; участок bс (справа от Б. т.) cooтветствует условиям меньшей
сжимаемости реального газа по сравнению с идеальным. Слева от Б. т. сказывается
преоблаюдающее влияние сил притяжения между молекулами, облегчающих сжатие
газа справа от Б. т.- влияние собственного объёма молекул, препятствующего
сжатию. Вблизи Б. т. эти факторы, отличающие реальный газ от идеального,
взаимно компенсируются.
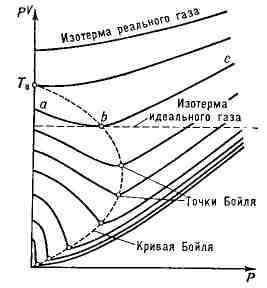
Изотермы реального газа в координатах
Линия, соединяющая Б. т. отдельных изотерм,
Ю. Н. Дрожжин.
А
Б
В
Г
Д
Е
Ё
Ж
З
И
Й
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Ъ
Ы
Ь
Э
Ю
Я
Р - pV, характеризующие сжимаемость газа. Т
наз. кривой Бойля. Точка этой кривой, лежащая на оси ординат (р = 0), определяет
т. н. темп-ру Бойля Т
уравнению, Т
сжижение газа под давлением, при Т<Т
сжижение газов при дросселировании, см. Джоуля - Томсона явление.