БИООРИЕНТАЦИЯ
(от био... и
ориентация),
способность
организмов определять своё местонахождение в пространстве, выбирать оптимальное
положение по отношению к действующим на него силам (факторам среды) и определять
биологически целесообразное направление движения. Б.- одно из осн. условий
приспособления организмов к окружающей среде (адаптации),
что может
осуществляться тремя путями: изменением состояния организма в соответствии
с меняющимися условиями (морфо-физиол. адаптация); сменой мест обитания
(см. Кочёвки животных, Миграции животных):
изменением обстановки
путём образования скоплений (стай, стад и т. п.) или постройки убежищ (нор,
гнёзд и т. п.). Б. основана на свойстве раздражимости и восприятия внеш.
воздействий физич., химич. и биол. природы. У высших беспозвоночных (членистоногие,
моллюски) и у позвоночных животных восприятие, или рецепция, внеш. воздействий
(сигналов) осуществляется спец. органами чувств, а их реакции Б. приобретают
характер сложных инстинктов,
лежащих в основе
бионавигации. Выбор
направления при передвижениях осуществляется на основании рецепции химич.,
механич. (тактильных), акустич., электрич. или оптич. раздражителей (сигналов)
и их локации, т. е. определения положения по отношению к животному (см.
Биолокация).
Работа
большинства механизмов локации обеспечивается парностью органов чувств
(зрения, слуха, равновесия и др.), позволяющей сравнивать сигналы, сопоставляя
силу, частотную характеристику и др. параметры сигналов, поступивших в
правый и левый органы чувств, и т. о. определять направление их источника.
Лит.: Протасов В. Р., Биоакустика
рыб, М., 1965; Бионика. [Сб. ст.], М., 1965; Мазохин-Поршняков Г. А., Зрение
насекомых, М., 1965; Глезер В. Д., Механизмы опознания зрительных образов,
М.- Л., 1966; Райт Р. X., Наука о запахах, пер. с англ.. М., 1966; Мили
Л. Дж. и М и л н М. Д ж., Чувства животных и человека, пер. с англ., М.,
1966; С л о н и м А. Д., Инстинкт загадки врожденного поведения организмов,
Л., 1967; Вопросы бионики. [Сб. ст.], М., 1967; Мартека В., Бионика, пер.
с англ., М., 1967; Протасов В. Р., Зрение и ближняя ориентация рыб, М.,
1968; Тинберген Н., Поведение животных, пер. с англ., М., 1969.
Н. П. Наумов.
БИОПОЛИМЕРЫ, высокомолекулярные
природные соединения, являющиеся структурной основой всех живых организмов
и играющие определяющую роль в процессах жизнедеятельности. К Б. относятся
белки, нуклеиновые кислоты и полисахариды; известны также смешанные Б.-
гликопротеиды, липопротеяды, гликолипиды и др.
Биологические функции Б. Нуклеиновые
кислоты выполняют в клетке генетич. функции. Последовательность мономерных
звеньев (нуклеотидов) в дезоксирибонуклеиновой кислоте -ДНК (иногда в рибонуклеиновой
кислоте - РНК) определяет (в форме генетического кода) последовательность
мономерных звеньев (аминокислотных остатков) во всех синтезируемых белках
и, т. о., строение организма и протекающие в нём оиохим. процессы. При
делении каждой клетки обе дочерние клетки получают полный набор генов благодаря
предшествующему самоудвоению (репликации) молекул ДНК. Генетич.
информация с ДНК переносится на РНК, синтезируемую на ДНК как на матрице
(транскрипция).
Эта
т. н. информационная РНК (и-РНК) служит матрицей при синтезе белка, происходящем
на особых органоидах клетки - рибосомах
(трансляция) при участии
транспортной РНК (т-РНК). Биол. изменчивость, необходимая для эволюции,
осуществляется на молекулярном уровне за счёт изменений в ДНК (см. Мутация).
Белки выполняют в клетке ряд важнейших
функций. Белки-ферменты осуществляют все химич. реакции обмена веществ
в клетке, проводя их в необходимой последовательности и с нужной скоростью.
Белки мышц, жгутиков микробов, клеточных ворсинок и др. выполняют сократит,
функцию, превращая химич. энергию в механич. работу и обеспечивая подвижность
организма в целом или его частей. Белки - осн. материал большинства клеточных
структур (в т. ч. в специальных видах тканей) всех живых организмов, оболочек
вирусов и фагов. Оболочки клеток являются липопротеид-ными мембранами,
рибосомы
построены
из белка и РНК и т. д. Структурная функция белков тесно связана с регуляцией
поступления различных веществ в субклеточные органеллы (активный транспорт
ионов
и др.)и с ферментативным катализом. Белки выполняют и регуляторные
функции (репрессоры), "запрещая" или "разрешая" проявление того
или иного гена. В высших организмах имеются белки - переносчики тех или
иных веществ (напр., гемоглобин - переносчик молекулярного кислорода) и
иммунные белки, защищающие организм от чужеродных веществ, проникающих
в организм (см. Иммунитет). Полисахариды выполняют структурную,
резервную и нек-рые др. функции. Белки и нуклеиновые к-ты образуются в
живых организмах путём матричного ферментативного биосинтеза.
Имеются
теперь и биохим. системы внеклеточного синтеза Б. с помощью ферментов,
выделенных из клеток. Разработаны методы химич. синтеза белков и нуклеиновых
к-т.
Первичная структура Б. Состав и последовательность
мономерных звеньев Б. определяют их т. н. первичную структуру. Все нуклеиновые
к-ты являются линейными гетерополимерами-сахарофосфатными цепочками, к
звеньям к-рых присоединены боковые группы -азотистые основания: аденин
и тимин (в РНК - урацил), гуанин и цитозин; в нек-рых случаях (гл. обр.
в т-РНК) боковые группы могут быть представлены др. азотистыми основаниями.
Белки -также гетерополимеры; молекулы их образованы одной или неск. полипептидными
цепочками, соединёнными дисульфид-ными мостиками. В состав полипептидных
цепей входит 20 видов различных мономерных звеньев - остатков аминокислот.
Мол. масса ДНК варьирует от неск. млн. (у мелких вирусов и бактериофагов)
до ста млн. и более (у более крупных фагов); бактериальные клетки содержат
по одной молекуле ДНК с мол. массой в неск. млрд. ДНК высших организмов
может иметь и большую мол. массу, ноизмерить её пока не удалось из-за разрывов
в молекулах ДНК, возникающих при их выделении. Рибосомные РНК имеют мол.
массу от 600 тыс. до 1,1 млн., информационная (и-РНК) - от сотен тысяч
до неск. миллионов, транспортная (т-РНК) - ок. 25 тыс. Мол. масса белков
варьирует от 10 тыс. (и менее) до миллионов; в последнем случае, однако,
обычно возможно разделение белковой частицы на субъединицы, соединённые
между собой слабыми, б. ч. гидрофобными, связями.
К о н ф о р м а ц и я, т. е. та или иная
пространственная форма молекул Б., определяется их первичной структурой.
В зависимости от хим. строения и внеш. условий молекулы Б. могут находиться
либо в одной или в неск. преимущественных конформациях (обычно встречающиеся
в природных условиях нативные состояния Б.: напр., глобулярное строение
белков, двойная спираль ДНК), либо принимать многие б. или м, равновероятные
конформации. Белки делят по пространственной структуре на фибриллярные
(нитевидные) и глобулярные; белки-ферменты, белки-переносчики, иммунные
н нек-рые др. имеют, как правило, глобулярную структуру. Для ряда белков
-гемоглобин, миоглобин, лизоцим, рибонуклеаза и др.- эта структура установлена
во всех деталях (с определением при помощи рентгеноструктурного анализа
расположения каждого атома). Она определяется последовательностью аминокислотных
остатков и образуется и поддерживается относительно слабыми взаимодействиями
между мономерными звеньями полипептидных цепей в водносолевом растворе
(кулоновские и диполь-ные силы, водородные связи, гидрофобные взаимодействия),
а также дисульфидными связями. Глобула белка формируется так, что большинство
полярных гидрофильных аминокислотных остатков оказывается снаружи и контактирует
с растворителем, а большинство неполярных (гидрофобных) остатков находится
внутри и изолировано от взаимодействия с водой. Молекулы белка, обладающие
избытком неполярных групп, когда часть из них оказывается на поверхности
глобулы, образуют высшую, т. ц. четвертичную структуру, при к-рой неск.
глобул агрегируют, взаимодействуя между собой в основном неполярными участками
(рис. 1). Пространств, структура каждого белка-фермента уникальна и обеспечивает
необходимое для его функционирования расположение в пространстве всех звеньев
Б., в особенности т. н. активных центров. В то же время она не абсолютно
жестка и допускает необходимые в процессе функционирования (при взаимодействии
с субстратами, ингибиторами и др. веществами) конформационные сдвиги и
изменения.
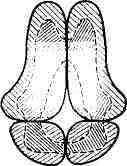
Рис. 1. Образование четвертичной структуры
глобулярных белков. Заштрихованы редко -полярные (гидрофильные ) части
белковых глобул, густо - неполярные (гидрофобные) области.
Пространств, структура нативной ДНК образована
двумя комплементарными нитями и представляет собой двойную спираль Крика
- Уотсона; в ней противоположные азотистые основания попарно связаны водородными
связями - аденин с тимином и гуанин с цитозином. Устойчивость двойной спирали
обеспечивается, наряду с водородными связями, также гидрофобным взаимодействием
между плоскими кольцами азотистых оснований, расположенных стопкой (стопочное
взаимодействие, или стакинг). Нити РНК спирализованы лишь частично. ДНК
вирусов, бактериофагов, бактерий а также митохондриальная в ряде случаев
представляет собой замкнутое кольцо; при этом наряду со спиралью Крика
- Уотсона наблюдается ещё дополнительная т. н. сверхспирализация.
Денатурация Б. Нарушение нативной пространств,
структуры Б. при различных воздействиях (повышение темп-ры, изменение концентрации
металлов, кислотности раствора и др.) наз. денатурацией и в ряде случаев
обратимо (обратный процесс наз. ренатурацией; рис. 2). Молекулы Б.- кооперативные
системы; поведение их зависит от взаимодействий составляющих частей. Коопера-тивность
молекул Б. определяется тем, что повороты отдельных звеньев из-за внутримолекулярных
взаимодействий зависят от конформации соседних звеньев. В основе денатурации
Б. при изменении внешних условий обычно лежат кооперативные конформационные
превращения (напр., переходы сс-спираль - b-структура, а-спираль - клубок,
b-структура -клубок для полипептидов, переход глобула - клубок для глобулярных
белков, переход спираль - клубок для нуклеиновых к-т). В отличие от фазовых
переходов (кипение жидкости, плавление кристалла), являющихся предельным
случаем кооперативных процессов и происходящих скачком, кооперативные переходы
Б. совершаются в конечном, хотя и сравнительно узком, интервале изменений
внешних условий. В этом интервале одномерные, линейные молекулы (нуклеиновые
к-ты,полипептиды), претерпевающие переход спираль - клубок, разбиваются
на чередующиеся спиральные и клубкообразные участки (рис. 3).
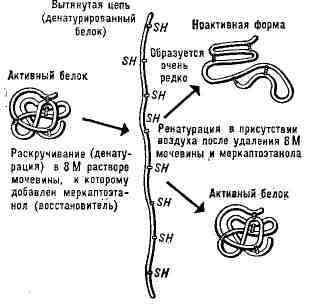
Рис. 2. Схема денатурации и ренатурации
глобулярного белка (на примере фермента рибонуклеазы).
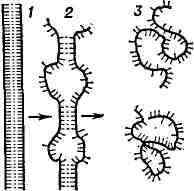
Рис. 3. Схема перехода спираль - клубок
для ДНК: 1 -нативное состояние (вместо двойной спирали для простоты изображена
"верёвочная лестница"); 2 - состояние ДНК в области перехода; 3 - денатурированное
состояние (однонитевые клубки).
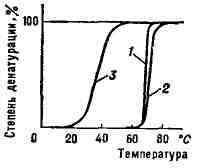
Рис. 4. Кривые перехода спираль - клубок
(денатурации) нуклеиновых кислот из различных организмов: 1 - бактериальная
ДНК; 2 - ДНК из зобной железы телёнка; 3 - РНК вируса табачной мозапки.
Переход спираль - клубок в ДНК наблюдается
при повышения темп-ры, добавлении в раствор к-ты или щёлочи, а также под
влиянием др. денатурирующих агентов. Этот переход в гомополи-нуклеотидах
происходит при нагревании в интервале десятых долей °С, в фаговых и бактериальных
ДНК - в интервале 3-5°С (рис. 3), в ДНК высших организмов - в интервале
10-15°С. Чем выше гетерогенность ДНК, тем шире интервал перехода и меньше
способность молекул ДНК к ренатурации. Переход спираль - клубок в различных
видах РНК носит менее кооперативный характер (рис. 4) и происходит в более
широком интервале темп-рных или др. денатурирующих воздействий.
Б.- полимерные электролиты, их пространственная
конформация и кооперативные переходы зависят как от степени ионизации молекулы,
так и от концентрации ионов в среде, что влияет на электростатич. взаимодействия
как между отдельными частями молекулы, так и между Б. и растворителем.
Строение и биологи ч. функции Б. Строение
Б.- результат длит, эволюции на молекулярном уровне, вследствие чего эти
молекулы идеально приспособлены к выполнению своих биологич. задач. Между
первичной структурой, конформацией Б. и конформационными переходами, с
одной стороны, и их биол. функциями - с другой, существуют тесные связи,
исследование к-рых - одна из гл. задач молекулярной биологии. Установление
таких связей в ДНК позволило понять осн. механизмы репликации, транскрипции
и
трансляции,
а
также мутагенеза и нек-рых др. важнейших биологич. процессов. Линейная
структура молекулы ДНК обеспечивает запись генетич. информации, её удвоение
при матричном синтезе ДНК и получение (также путём матричного синтеза)
мн. копий с одного и того же гена, т. е. молекул и-РНК. Сильные ковалентные
связи между нуклеотидами обеспечивают сохранность генетич. информации при
всех этих процессах. В то же время относительно слабые связи между нитями
ДНК и возможность вращения вокруг простых химич. связей обеспечивают гибкость
и лабильность пространств. структуры, необходимые для разделения нитей
при репликации и транскрипции, а также подвижность молекулы и-РНК, служащей
матрицей при биосинтезе белка (трансляция). Исследование пространств, структуры
и конформационных изменений белков-ферментов на разных стадиях ферментативной
реакции при взаимодействии с субстратами и коферментами даёт возможность
установить механизмы биокатализа и понять природу огромного ускорения хим.
реакций, осуществляемого ферментами.
Методы исследования Б. При исследовании
строения и конфор-мацнонных превращений Б. широко используются как очищенные
природные Б., так и их синтетич. модели, к-рые проще по строению и легче
поддаются исследованию. Так, при изучении белков моделями служат гомогенные
или гетерогенные полипептиды (с заданным или случайным чередованием аминокислотных
остатков). Моделями ДНК и РНК являются соответствующие синтетич. гомогенные
или гетерогенные полинуклеотиды. К методам исследования Б. и их моделей
относятся рентгеноструктурный анализ, электронная микроскопия, изучение
спектров поглощения, оптич. активности, люминесценции, методы светорассеяния
и динамич. двойного лучепреломления, седиментационный метод, вискозиметрия,
физико-химич. методы разделения и очистки и ряд др. Все методы, разработанные
для изучения синтетич. полимеров, применимы и к Б. При трактовке свойств
Б. и их моделей, закономерностей их конформационных превращений используются
также методы теоретич. физики (статистич. физики, термодинамики, квантовой
механики и др.).
Лит.: Б р е с л е р С. Е.. Введение
в молекулярную биологию, М. - Л., 1966; В о л ь к е н ш т е й н М. В.,
Молекулы и жизнь, М., 1965; Уотсон Дж., Молекулярная биология гена, пер.
с англ., М., 1967; Физические методы исследования белков и нуклеиновых
кислот, М., 1967. Ю. С. Лазуркин.
А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Ъ Ы Ь Э Ю Я