Структура Б.
Белок всех организмов
состоит из 20 видов аминокислот. Каждый Б. характеризуется определённым
ассортиментом и количественным соотношением аминокислот. В молекулах Б.
аминокислоты соединены между собой пептидными связями (-СО--NH-) в линейной
последовательности (рис. 1), составляющей так наз. первичную структуру
Б. Аминокислотные (полипептидные) цепи, содержащие аминокислоту цистин,
в местах его расположения скреплены дисульфидны-ми связями (-S-S-). Между
аминокислотами в Б., как правило, не существует иных хим. связей, кроме
пептидпых и дисульфидных.
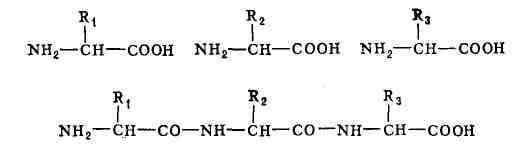
Рис. 1. Схема соединения аминокислот. Верхняя
Для каждого Б. не только состав, но и последовательность
Пространственная конфигурация (конформация)
спиралью или образовывать полностью вытянутые
Рис. 2. Схема трёхмерной структуры фермента
Конформация нек-рых Б., напр, лизоцима
Каждый из бесчисленного множества существующих
Изучение структуры Б. даёт возможность
Рис. 3. Модель молекулы миоглобина (пространственная
строка - свободные аминокислоты с боковыми группами R
аминокислот в полипептид-ной цепи - первичная структура - строго индивидуальны;
любое звено цепи -вполне определённая аминокислота. Все многочисленные
виды Б., существующие в природе, различаются по первичной структуре; потенциально
возможное их число практически неограничено. Индивидуальная первичная структура
каждого Б. сохраняется в поколениях благодаря точной передаче соответствующей
наследственной информации (см. ниже Биосинтез Б.). Для анализа первичной
структуры Б. разработаны специальные методы. При переваривании определёнными
ферментами, напр, трипсином, каждый Б. даёт свой набор фрагментов (пептидов).
При соответствующем их разделении на листе бумаги получается "пептидная
карта", к-рая, подобно отпечатку пальца, характерна для данного Б. Разделение
на пептиды и определение строения каждого из них в отдельности - основной
путь расшифровки первичной структуры ' Б. Кроме пептидных и дисульфидных
связей, в молекуле Б. есть многочисленные связи с меньшей энергией взаимодействия,
имеющие большое значение для внутренней организации и функции Б. Среди
этих связей наиболее существенны т. н. гидрофобные связи, создаваемые неполярными
боковыми группами аминокислот. Эти группы, лишённые сродства к воде, имеют
тенденцию контактировать между собой внутри молекулы Б. Кроме того, в молекуле
Б. имеются водородные связи, образуемые полярными группами, напр. -СО-NH-,
а также электростатические взаимодействия между группами, несущими электрические
заряды.
полипептидной цепи Б. определяется его первичной структурой и условиями
среды. При обычных условиях (темп-pa не выше 40°С, нормальное давление
и т. д.) Б. характеризуются внутримолекулярной упорядоченностью. "Хребет"
полипептид-
![]()
отрезки (вторичная структура). В обоих случаях возникает система водородных
связей. Но в значит, части "хребта" геометрич. регулярность может отсутствовать.
Полипептид-ная цепь в целом "упаковывается" и жёстко фиксируется с помощью
взаимодействий боковых групп аминокислот (т р е-тичная структур а). В зависимости
от укладки поли-пептидных цепей форма молекул Б. варьирует от фибриллярной
(вытянутой, нитеобразной ) до глобулярной (округлой). Детальная конфигурация
глобулярных молекул сложна и своеобразна для каждого Б. В молекуле превалирует
совершенная упорядоченность, распространяющаяся на положение отд. атомов.
Однако нек-рые периферич. участки могут быть закреплены менее жёстко, а
погружённые в растворитель гидрофильные боковые группы остаются вполне
гибкими.
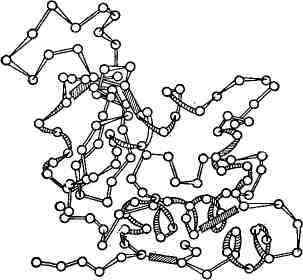
лизоцима. Кружки - аминокислоты; тяжи - пептидные связи; заштрихованные
прямоугольники - дисульфидные связи. Видны спирализованные и вытянутые
участки полнпептидной цепи.
(рис. 2), раскрыта рентгеноструктурными исследованиями. Создание упорядоченной
прочной конформации Б. определяется целыми системами взаимодействий, находящихся
во взаимной зависимости. Смены конформации Б., вызываемые изменениями среды
или реакциями, в к-рые Б. вступают, связаны с изменением ряда взаимодействий.
Конформацион-ные переходы охватывают молекулу Б. целиком или ограничиваются
определёнными районами. При нагревании, резком подкислении среды и др.
сильных воздействиях происходит "плавление" молекулы Б.- переход в состояние
беспорядочного клубка. Это, как правило, влечёт за собой ряд др. превращений,
общий результат к-рых обозначают как денатурацию Б. (см. Биополимеры).
При
этом понижается растворимость Б., усиливается вязкость их растворов, теряются
ферментативные и др. биол. свойства.
Б. имеет особую наследственно детерминированную первичную структуру, присущую
только ему. Это обусловливает строго индивидуальную систему внутримолекулярных
связей, т. е. уникальную конформацию Б. Поэтому каждый Б. характеризуется
собственной "химической топографией" и своеобразными сочетаниями пространственно
сближенных химич. групп. Часть таких сочетаний служит функциональными центрами
молекул Б. Благодаря структурному соответствию, напоминающему отношение
ключа к замку (комплементарности), функциональные центры "узнают" и избирательно
присоединяют вещества, на к-рые соответствующие Б. "установлены". Функциональные
- активные центры Б.-ферментов специфически присоединяют субстраты
и активируют их, ускоряя и направляя химич. превращения. При помощи особых
центров взаимного связывания ("контактных площадок") определённые Б. соединяются
по нескольку вместе (структура 4-го порядка) или создают значительно более
сложные системы (самосборка крупных белковых структур). Процессы самосборки
существенны для морфогенеза.
переходить к их синтезу. В 1955 была выяснена структура инсулина, молекула
к-рого состоит из двух сравнительно коротких полипептидных цепей (21 и
30 аминокислотных остатков). Вслед за этим была раскрыта первичная структура
гемоглобина,
рибонуклеазы,
трипсина и ряда др. Б. (рис. 3). Путём хим. синтеза сначала были
получены сложные пептиды со свойствами
гормонов, затем удалось синтезировать
гормон инсулин, наконец - фермент рибонуклеазу. Правильность хим. формулы
инсулина и рибонуклеазы подтвердилась тем, что синтетич. Б. не отличались
от Б., продуцируемых организмом, ни по физико-хим. свойствам, ни по биол.
активности. Установлена полностью или частично первичная структура св.
200 Б.
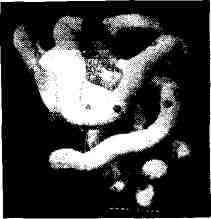
конфигурация молекулы).
А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Ъ Ы Ь Э Ю Я